[ Deutsch ] [ English ] [ Русский ]
Herzlich willkommen!
molekulartherapie.de
Eine universelle Theorie & Therapie der Erkrankungen des zentralen Nervensystems
Zellschwachstellen und Affektive Störungen
Kapitel 4 A: Potentielle Zellschwachstellen und Affektive Störungen
4.1 Rückblick auf Kapitel 1 bis 3 und Ausblick auf die Inhalte von Kapitel 4▲
Wichtige Ergebnisse der Kapitel 1 bis 3
Aus kausaltheoretischer Sicht beruhen Affekterkrankungen auf einem dreistufigen funktional‑strukturellen Veränderungsprozess in affektverarbeitenden Hirnaraealen, der durch sinkende Funktions‑ und Vernetzungsfähigkeiten von Nerven‑ und Gliazellen und deren Abbau charakterisiert ist. Durch diese Prozesse verschlechtern sich affektrelevante Reizverarbeitungsaktivitäten quantitativ und qualitativ (→ 3‑Stufen‑Modell).
Dieser komplexe multikausale Veränderungsprozess der affektiven Reizverarbeitung resultiert aus Zellprozessstörungen, für die zahlreiche endogene Zellschwachstellen und/oder exogene Noxen (Umwelt, Stressfaktoren) verantwortlich sein können:
Zellschwachstellen/Noxen → Zellprozessstörungen → Reizverarbeitungsstörungen
Eine Zellprozessanalyse ergibt:
- Zehn Substanzen(‑gruppen) werden für den korrekten Ablauf aller Zellprozesse benötigt, acht davon sind ursächlich dafür verantwortlich und werden daher als Kausalfaktoren bezeichnet:
- Aminosäuren als Bestandteile aller Peptide (vor allem Enzyme und Proteine) und Monoamine,
- Glukose für die zelluläre Energieversorgung,
- Mikronährstoffe in Form von Vitaminen, Mineralstoffen und Spurenelementen für sämtliche Zellprozesse,
- Lipide und Lipoïde für Energieversorgung, Zellmembranaufbau und verschiedene Zellprozesse,
- nicht-codierende Ribonukleinsäuren (ncRNA) zur Durchführung und Modulation der Proteinbiosynthese auf der oberen Zellprozessebene (Genregulation),
- Sauerstoff für die zelluläre Energieversorgung,
- Wasser für sämtliche Zellprozesse und
- die ursprüngliche Erbinformation der Elterngeneration, die als Erstausstattung mit DNA‑Codes eine Grundlage der späteren Peptid‑ und ncRNA‑Synthese ist.
Potentiell resultieren aus acht Kausalfaktormängel acht Ursachenkomplexe für Zellstoffwechselprobleme und damit acht Zellschwachstellen.
- Bei den beiden restlichen, nicht zu den Kausalfaktoren gerechneten Substanzen, handelt es sich um Zell‑DNA und Boten‑RNA, die beide lediglich eine Informationsüberträgerfunktion innerhalb der Proteinbiosynthese haben. Zell‑DNA wird im Zellmodell daher nicht den Kausalfaktoren zugeordndet. Zell‑DNA und die ursprüngliche Erbinformation dürfen daher nicht verwechselt oder miteinander gleichgestellt werden. Zell‑DNA basiert zwar auf der Erbinformation, stellt im Modell aber eine eigenständige Substanz dar. Zell‑DNA dient der Proteinbiosynthese lediglich zur Herstellung einer Matrize (= Boten‑RNA), mit deren Hilfe Enzyme und Proteine direkt synthetisiert werden. Ebenfalls werden mittels Zell‑DNA ncRNA‑Moleküle transkribiert, deren Codes sich auf der DNA befinden. Die hohe Bedeutung der Zell‑DNA beruht auf deren Gefährdung durch somatische Mutationen als neunter Zellschwachstelle.
- Sieben der acht Kausalfaktoren (Nr. 1 bis 7) sind in jeder Zelle zu jedem Zeitpunkt stoffwechselaktiv.
- Die ursprüngliche Erbinformation (Nr. 8) ist als ein aus der Vergangenheit stammender Kausalfaktor zwar nicht stoffwechselaktiv, stellt aber eine wichtige Grundlage jeder Zelle dar und ist weder Bestandteil der oberen noch der unteren Zellprozessebene.
- Nicht‑codierende Ribonukleinsäuren (Nr. 5) werden als einzige stoffwechselaktive Kausalfaktorgruppe ausschließlich in der Zelle durch Transkription synthetisiert, während die restlichen sechs stoffwechselaktiven Faktoren einer Zelle entweder durch Nahrung oder Atmung in den Organismus bzw. die Zelle gelangen.
- Somatische Mutationen der Zell‑DNA stellen eine weitere Zellschwachstelle dar. Durch diese neunte Zellschwachstelle wird die Dominanz der acht Kausalfaktoren allerdings nicht tangiert, denn Kausalfaktoren bestimmen maßgeblich auch die Funktionsfähigkeit der DNA‑Reparaturprozesse ‑ und damit auch Art und Anzahl somatischer DNA‑Mutationen. Mangel oder Mängel an Kausalfaktoren behindern daher auch DNA‑Reparaturprozesse und führen dadurch zu einer erhöhten Anzahl somatischer Mutationen, wohingegen eine optimale Kausalfaktorenversorgung die Anzahl von DNA-Mutationen minimiert.
Eine Relevanzanalyse ergibt, dass dysfunktionale ‑ also fehlende oder fehlerhafte ‑ Kausalfaktoren Zellprozesse auf unterschiedliche Weise stören und vor allem unterschiedliche Störpotentiale haben. Die größten Gefahren drohen einer Zelle durch dysfunktionale ncRNA, beispielsweise fehlende oder fehlerhafte micro‑RNA‑ oder circular‑RNA‑Moleküle, woduch die Genregulation ‑ einer der wichtigsten Zellprozesse überhaupt ‑ aus dem Ruder läuft.
Die große Bedeutung der ncRNA-Moleküle resultiert nicht nur aus deren engen Verbindungen mit der Proteinbiosynthese auf der oberen Zellprozessebene. Sie resultiert auch aus der Gefährdung ihrer auf der DNA lokalisierten ncRNA-Codes durch Keimbahn- und vor allem somatische Mutationen, denn ncRNA-Moleküle müssen in der Zelle synthetisiert werden, was ncRNA-Moleküle von allen anderen stoffwechselaktiven Kausalfaktoren unterscheidet.
Zur Systematik der multikausalen Analyse in Kapitel 4
Da im vierten Kapitel eine hohe Anzahl endogener und exogener Auslöser (Noxen) von Zellprozessstörungen und affektiven Erkrankungen identifiziert und analysiert wird, ist eine Systematik zur Orientierung in der komplexen Thematik notwendig. Deshalb werden die Folgen endogener Zellschwachstellen und exogener Noxen voneinander getrennt analysiert.
Da Zellschwachstellen die schädlichen Aktivitäten exogener Noxen oft erst ermöglichen oder zumindest unterstützen, erfolgt die Analyse darüber hinaus beginnend mit Zellschwachstellen hintereinander:
- Teil A mit neun Zellschwachstellen in den Abschnitten 4.2 bis 4.10
- Teil B mit sonstigen exogenen Noxen ab Abschnitt 4.11
Aufgrund zahlreichen Verbindungen zwischen Zellschwachstellen und exogenen Noxen sind redundante Darstellungen unvermeidlich. Sie helfen dabei, Unklarheiten und Missverständnissen vorzubeugen und werden auf ein Minimum begrenzt. Grundlagen aller Analysen sind die hier vorgestellten Thesen und Modelle. Sofern möglich, werden empirische Untersuchungen, Forschungsergebnisse, weitere Theorien oder erfahrungsmedizinische Erkenntnisse berücksichtigt.
Aus technischen Gründen sind die Inhalte des Kapitels 4 auf zwei Webseiten verteilt worden. Teil 4 A startet mit der Analyse somatischer DNA-Mutationen. Im Anschluss werden Ursachen und Auswirkungen der Mangel- und Mängelzustände von acht Kausalfaktoren in der Reihenfolge ihrer Relevanz erörtert:
- Kapitel 4 A - Zellschwachstellen und Affektive Störungen
4.2 Auswirkungen somatischer Mutationen auf Affekte und Affektstörungen
Probleme mit Kausalfaktoren geringer Relevanz und deren Auswirkungen auf Affekte und Affektstörungen
4.3 Aminosäurenmangel und Affektstörungen
4.4 Mikronährstoffmangel und Affektstörungen
4.5 Mangel an Nahrungsfetten bzw. Fettbegleitstoffen und Affektstörungen
4.6 Wassermangel und Affektstörungen
Probleme mit Kausalfaktoren mittlerer Relevanz und deren Auswirkungen auf Affekte und Affektstörungen
4.7 Schäden der ursprünglichen Erbinformation und Affektstörungen
4.8 Glukosemangel und Affektstörungen
4.9 Sauerstoffmangel und Affektstörungen
Probleme mit Kausalfaktoren hoher Relevanz und deren Auswirkungen auf Affekte und Affektstörungen
4.10 Mangel und Schäden an nicht-codierenden Ribonukleinsäuren und Affektstörungen
Die Darstellung der Zusammenhänge zwischen exogenen Noxen und Affekterkrankungen (Teil 4 B) startet mit der Diskussion der Folgen psycho‑sozialen (Dis)‑Stresses. Danach werden Auswirkungen physikalisch-chemischer und biotischer bzw. biologisch-medizinischer Noxen nacheinander untersucht:
- Kapitel 4 B - Sonstige exogene Noxen und Affektive Störungen
4.12 Psycho-sozialer Disstress und Affektstörungen
4.13 Abiotische physikalisch-chemische Noxen und Affektstörungen
- Lichtmangel
- Mobilfunkstrahlung
- Ionisierende Strahlung
- Traumata
- Lärm
- Zellatmung und freie Radikale bzw. ROS/Sauerstofftoxikose
- Gift- und Schadstoffe
- Suchtstoffe
4.14 Biotische und biologisch-medizinische Noxen und Affektstörungen
- Auswirkungen verschiedener Medikamente gegen innere Erkrankungen auf Affekte und Affektstörungen
- Neurologische Aspekte von Narkosemedikamenten und Zusammenhänge mit Affektstörungen
- Darmerkrankungen und Affektstörungen
- Immunsystem und Affektstörungen
- Hormonsystem und Affektörungen
- Erhöhte Körpertemperatur (Fieber)
- (...)
- (...)
4.2 Auswirkungen somatischer Mutationen auf Affekte und Affektstörungen▲
Als somatische Mutationen werden Veränderungen der Zell-DNA bezeichnet; sie können zu Zellstoffwechselanomalien mit Zellprozessstörungen, Einschränkungen der Zellfunktionen, einem Zelluntergang oder verschiedenen Erkrankungen einschließlich malignen ‑ d. h. bösartigen ‑ Zellveränderungen führen und beruhen in der Regel auf bekannten endogenen oder exogenen Faktoren (Noxen), aber auch ein physiologischer Ursprung ohne erkennbaren Anlass ist möglich.
Im Abschnitt 4.2 geht es um die Frage, wie Zellstoffwechselveränderungen neurologisch‑psychiatrische Erkrankungen ‑ hier: Affektstörungen ‑ beeinflussen. Die Frage betrifft damit den letzten Teil der gesamten Kausalkette:
Primärauslöser → Somatische Mutation → Zellstoffwechselveränderung → Affektstörung
Somatische Mutationen ≠ Keimbahnmutationen
Somatische Mutationen dürfen nicht mit Keimbahnmutationen verwechselt werden. Keimbahnmutationen bestehen schon zum Zeitpunkt der Keimzellenverschmelzung ‑ beispielsweise durch erblich bedingte fehlerhafte DNA‑Sequenzen der mütterlichen oder väterlichen Keimzellen ‑ und sind somit in sämtlichen Zellen des entstehenden Organismus von Beginn an enthalten. Sie betreffen damit den Gesamtorganismus und nicht nur einzelne Zellen oder Zellsysteme. Keimbahnmutationen schädigen die ursprüngliche Erbinformation als bedeutenden Kausalfaktor direkt und werden in Abschnitt 4.7 gesondert thematisiert.
Hinweise zur Darstellungssystematik in Abschnitt 4.2
Zum Einstieg in das Thema werden in Abschnitt 4.2.1 die in Kapitel 3 schon ausführlich dargestellten Ursachen und Kennzeichen von DNA-Veränderungen nochmal zusammengefasst.
Im darauffolgenden Abschnitt 4.2.2 stehen theoretische Analysen potentieller Mutationsfolgen anhand des Zellprozessmodells im Mittelpunkt. In Abschnitt 4.2.3 wird grob geprüft, ob die Ergebnisse mit Theorien vereinbar sind, bei denen somatische DNA-Veränderungen mit der Alterung des Organismus in einen Kausalzusammenhang gebracht werden. Zum Schluss gibt Abschnitt 4.2.4 eine Übersicht der Erkenntnisse empirischer Untersuchungen über langfristige Wirkungen somatischer Mutationen auf Zellalterung, Zentralnervensystem und affektive Erkrankungen.
4.2.1 Rückblick: Primärursachen und Charakteristika somatischer Mutationen
Verschiedene Ereignisse können somatische Mutationen mit unterschiedlichen Mutationsmerkmalen verursachen. Fragen dazu betreffen den linken Teil der Kausalkette:
Primärauslöser → Somatische Mutation → Zellstoffwechselveränderung → Erkrankung
Somatische Mutationen werden nach folgenden Entstehungsprozessen klassifziert:
- Informationsübertragungsfehler während der Zellteilung
Bei der DNA-Replikation wird das gesamte Genom der Zelle in Vorbereitung der Zellteilung verdoppelt. Dabei kann es zu drei verschiedenen Übertragungsfehlern auf den neuen DNA-Strang kommen, seltener sind Schäden am zu replizierenden, ursprünglichen DNA‑Strang.
Bei einer Substitution sind DNA‑Basen bzw. Nukleotide nicht komplementär zum Partner (Mismatch → Animation 13). Bei einer Deletion fehlen DNA‑Basen/Nukleotide, bei einer Insertion werden überflüssige DNA‑Basen/Nukleotide eingefügt. Bei allen Formen können sowohl einzelne Basen/Nukleotide (Punktmutation) als auch mehrere Basen/Nukleotide betroffen sein.
- Informationsübertragungsfehler bei der Übersetzung des DNA‑Codes in Boten‑RNA
Auch bei der Transkription ist die DNA gefährdet, zum Beispiel während des Aufbrechens der beiden DNA‑Stränge oder des Ablesens eines Gens oder ncRNA‑Codes durch eine RNA‑Polymerase.
- Nicht-natürliche und natürliche Mutagene (Noxen)
Nicht‑natürlich induzierte Mutationen drohen bei besonderen, nicht alltäglichen und gefährlichen Situationen, zum Beispiel durch künstlich erzeugte Radioaktiviät oder bei einer außergewöhnlich hohen Freisetzung industrieller Umweltgifte. Diese Mutagene nicht‑natürlichen Ursprungs dringen tief in den Körper ein und können die DNA von Nerven‑ und Gliazellen und weiteren Zellarten schädigen (Beispiele im nachfolgenden Abschnitt).
Natürlich induzierte Mutationen werden im Gegensatz dazu von natürlichen Mutagenen ausgelöst, die bei jeder Lebensweise unvermeidlich auftreten. Dazu zählen vor allem reaktive Sauerstoff-Spezies bzw. ROS, zum Beispiel freie Sauerstoffradikale, die bei einer durchschnittlichen Energieerzeugung in jeder Zelle entstehen. Die Zelle ist hier in einem Dilemma, denn sie benötigt für ihre Energieversorgung dringend Sauerstoff, der wiederum für oxidativen Stress sorgt und die DNA schädigen kann (Beispiele im nachfolgenden Abschnitt)..
Verschiedene DNA-Veränderungen können die Folgen sein. Bei der Basenoxidation geben Basenatome Elektronen an reaktive Substanzen ab, z. B. an freie Radikale. Bei der Desaminierung kommt es zu fehlerhaften Basenpaarungen aufgrund chemischer Veränderungen an der DNA. Werden die Purinbasen Adenin und Guanin vom DNA-Gerüst abgespalten, wird das als Depurinierung bezeichnet, analog bedeutet Depyrimidinierung den vergleichbaren Vorgang mit den Pyrimidinbasen Cytosin und Thymin. Bei Chromosomenbrüchen sind zwei Subtypen zu unterscheiden, nämlich Brüche ohne Veränderungen an der Chromosomenstruktur und Brüche mit Chromosomenstrukturveränderungen. Darüber hinaus kann es zu einer Alkylierung oder Methylierung der DNA kommen.
Sowohl induzierte als auch natürlich-induzierte Mutagene (Noxen) sind darüber hinaus in der Lage, andere Zellbestandteile ‑ Lipide als Bausteine innerer oder äußerer Zellmembranen oder Enzyme bzw. Proteine ‑ zu schädigen.
- Physiologische Mutationen
Spontane DNA‑Veränderungen geschehen ohne erkennbaren Anlass. Sie müssen daher nicht zwangsläufig anlasslos sein, es besteht auch die Möglichkeit eines noch unbekannten oder nicht erkennbaren endogenen Mechanismus oder einer unbekannten exogenen Noxe. Sie unterscheiden sich im Ergebnis nicht von noxeninduzierten Mutationen (→ Nr. 2 oben).
Nicht-natürlich induzierende und natürlich induzierende Mutagene
Eigenschaften und Auswirkungen einzelner Mutagene bzw. Noxen auf Affekte und Affektstörungen werden ab Abschnitt 4.12 noch ausführlich dargestellt, hier nur einige Beispiele:
- Künstlich produzierte radioaktive Strahlung hat das Potential, DNA und andere Zellstrukturen sowohl direkt als auch durch eine massiv vermehrte Entstehung freier Radikaler und ROS indirekt zu schädigen. Die Radioaktivität in belasteten Gegenden Japans (Fukushima, Nagasaki, Hiroshima) oder in der „Todeszone“ um die Tschernobyl-Reaktorruine in der Ukraine sind Beispiele für eine massiv erhöhte Radioaktivität aus künstlichen Quellen. Natürliche Radioaktivität gehört dagegen zu den natürlich induzierenden Mutagenen, denn sie ist als Naturphänomen jederzeit und überall präsent. Auch sie dringt tief in den Körper ein und erreicht das zentrale Nervensystem. Der Unterschied zur erhöhten künstlich erzeugten Radioakativität besteht u. a. in einem in der Regel geringeren Schädigungspotential aufgrund geringerer Strahlungsintensität.
- Bestimmte chemische Noxen lassen sich ebenfalls nicht vermeiden. Nitrosamine, die durch eine Anhäufung von Nitraten und Nitriten in Lebensmitteln entstehen, schädigen die DNA durch Alkylierung, die bei einem durchschnittlichen Verzehr durchschnittlich belasteter Nahrung ebenfalls zu den natürlich‑induzierten Mutationen gezählt werden. Im Gegensatz dazu gilt der übermäßige Konsum von Nitrosaminen als nicht‑natürlich, zum Beispiel durch hochbelastete Lebensmittel. Es wurden Zusammenhänge zwischen nitrithaltigen Fleischprodukten und einer steigenden Zahl von Nervenerkrankungen, wie Morbus Parkinson oder der Alzheimer‑Demenz, festgestellt. Auch durch Chemieunfälle belastete Regionen, beispielsweise die dioxinverseuchte Gegend um Seveso in Norditalien, die durch das Toxin MIC/Methylisocyanat geschädigte Stadt Bhopal in Indien oder die durch ein Zugunglück mit Chlorgas in Berührung gekommenen Bewohner der Ortschaft Graniteville im amerikanischen Bundesstaat South Carolina, erhöhen die Gefahr induzierter Mutationen bei der örtlichen Bevölkerung.
- Die Bindung der beiden Purinbasen Adenin und Guanin mit der Desoxyribose der DNA ist wärmeempfindlich und es kommt schon bei normaler Körpertemperatur zu thermischen Spaltungen und einem Purinbasenverlust. Pro Tag und Zelle sind nach Schätzungen etwa 5.000 Purinbasen von dieser natürlich-induzierten Depurinierung betroffen, die alle repariert werden müssen. Die Anzahl thermischer Spaltungen nimmt mit der Höhe der Körpertemperatur zu, so dass der Organismus bei Fieber mit wesentlich mehr Mutationen zu kämpfen hat. Fieber ist daher auch nicht mehr als natürlich-induziert zu werten.
- Vergleichbares gilt auch für die aus einer erhöhten Sauerstoffzufuhr resultierenden hochaggressiven ROS. Diese als Sauerstofftoxikose bezeichnete Vergiftung stellt eine Gefahr beim Tauchen oder Extrembergsteigen mit Sauerstoffflaschen dar oder auch bei der medizinischen Überdruckbeatmung in der Intensivmedizin bzw. während der Durchführung von Operationen. Bei einer Sauerstofftoxikose kann es kurzfristig auch zu Todesfällen kommen, da massiv auftretende Sauerstoffradikale Proteine und Zellmembranen massiv angreifen und dadurch in der Lage sind, Nervenzellen kurzfristig zu vernichten mit der Folge großflächiger Hirnschäden.
Ab wann aus einem natürlichen ein nicht natürliches Mutagen wird, ist nicht immer klar ersichtlich. So ist es schwierig, die Toxizität von Umweltgiften zu bewerten und Grenzwerte exakt zu bestimmen. Das gilt auch für Radioaktivität, denn ab welcher Strahlenbelastung hat der Mitarbeiter einer atomaren Anlage unter den gegebenen Sicherheitsstandards mit einem erhöhten gesundheitlichen Risiko zu rechnen? Neben wissenschaftlichen Erkenntnissen spielen hier politische Motive eine erhebliche Rolle für das, was noch als „natürliche Belastung“ verstanden werden soll.
4.2.2 Unmittelbare und langfristige Folgen somatischer Mutationen
Um sämtliche potentiellen Konsequenzen von Mutationen einordnen und bewerten zu können, müssen sowohl die unmittelbaren als auch die langfristigen Mutationswirkungen auf Zellebene analysiert werden, letztere auch auf Organebene. Beides hat differenziert nach Gen‑ und ncRNA‑Mutationen zu erfolgen.
Grundsätzlich: Unterscheidung zwischen sekundärer und primärer Proteinbiosynthesestörung
Auf jedem DNA‑Molekül befinden sich die Codes von Peptiden (hauptsächlich Enzymen und Proteinen) und nicht‑codierenden Ribonukleinsäuren (ncRNA, zum Beispiel micro‑RNA, tRNA, snRNA oder rRNA), wozu auch die zum Ablesen dieser Informationen notwendigen Marker gehören. Der Begriff des Gens bezieht sich dabei ausschließlich auf Peptid‑Codes. Um Verwechslungen zu vermeiden, lautet die vergleichbare Bezeichnung einer DNA‑Informationseinheit nicht‑codierender Ribonukleinsäuren ncRNA‑Code.
Die Proteinbiosynthese ist der wichtigste Zellprozess, denn hier werden aus den DNA‑Codes die für die Zelle notwendigen Moleküle synthetisiert. Naturgemäß ist der Proteinbiosyntheseprozess daher von DNA‑Mutationen am stärksten bedroht. Mutierte Gen‑ bzw. ncRNA‑Codes können dazu führen, dass die jeweiligen Moleküle entweder nicht in der nötigen Menge oder mit strukturellen Fehlern synthetisiert werden und ihre Aufgaben nicht mehr korrekt durchführen.
Zwei Formen mutationsbedingter Proteinbiosynthesestörungen sind zu unterscheiden, wobei Primärstörungen tendenziell mit größeren Risiken für eine Zelle verbunden sind:
- Sekundäre Störungen der Proteinbiosynthese liegen vor, wenn der eigentliche Vorgang der Proteinbiosynthese auf der oberen Zellprozessebene zwar korrekt abläuft, aber das abzulesende Gen mutationsgeschädigt ist (→ Abbildung 23 unten, Nr. 2 rechts).
Danach kann es zu Störungen auf der unteren Zellprozessebene in den von der Mutation betroffenen Bereichen kommen, also bei DNA‑Reparatur, Energieversorgung, Funktionalprozessen oder Zellteilung.
Ausnahmen sind Enzyme oder Proteine, die zur Durchführung oder Steuerung der Proteinbiosynthese notwendig sind. Mutationen führen hier aufgrund des Kreislaufs zwischen der unteren und oberen Prozessebene sofort zu Primärstörungen (→ nachfolgende Erklärung).
- Primäre Störungen der Proteinbiosynthese resultieren aus einer mutationsbedingten Fehl‑ oder Minderproduktion von proteinbiosynthesedurchführenden oder ‑modulierenden Molekülen. Sie sind gekennzeichnet durch Fehler bei der Durchführung von Transkription oder Translation, aber auch von Unzulänglichkeiten des Spleißvorgangs. Im weitesten Sinne zählen dazu auch Störungen post‑translativer Prozesse, bei denen Peptide abschließend noch verändert werden müssen, um ihre Aufgaben erfüllen zu können (→ Abbildungen 24 f. unten).
Zu den proteinsynthesrelevanten Peptiden gehören beispielsweise Aktivatoren, Helikasen, Repressor‑Proteine, RITS‑Proteine, RNA‑Polymerasen I, II oder III, Histone, Transkriptionsfaktoren, TBP, TREX, Cleavage‑Faktoren, PolyA‑Polymerasen, Spleißosome, Dicer‑Enzyme, Exportin 5, Argonautenproteine, RISC‑Proteine, EF‑G, EF‑Ts, EF‑Tu, eRF1 bis eRF3, iF1 bis iF11, Peptidyltransferasen, Ribosome, Chaperone, Chaperonine und Transportproteine (→ Kapitel 2).
Insbesondere jedoch führen fehlerhafte oder fehlende ncRNA-Moleküle zu Primärstörungen der Proteinbiosynthese. Sie entstehen durch Mutationen von ncRNA‑Codes bzw. deren DNA‑Markern, beispielsweise von Primern, rRNA, tRNA, snRNA, snoRNA, siRNA, miRNA, piRNA oder circRNA oder von Genen ncRNA‑synthetisierender Peptide. Wichtige Peptide zur ncRNA‑Transkription sind zum Beispiel RNA‑Polymerasen I und II, Dicer‑Enzyme und Exportin 5.
Zellprozessveränderungen und Dysfunktionalität als Folgen somatischer Mutationen
Art und Komplexität der Zellprozessstörungen resultieren daraus, welches Molekül auf welche Weise von einer Mutation betroffen ist. Mutationen führen tendenziell zu größeren Störungen, wenn die geschädigten Moleküle an besonders vielen oder besonders bedeutenden Zellprozessen beteiligt sind. Das gilt für Enzyme und Proteine, aber auch für die verschiedenen nicht‑codierenden Ribonukleinsäuren gleichermaßen.
Die Gefahr mutationsbedingter Prozessstörungen besteht in sämtlichen Zellbereichen: Proteinbiosynthese, DNA‑Reparatur, Energieversorgung, Zellteilung und natürlich auch in den speziellen Zellfunktionsbereichen. Besonders in diesen Bereichen sind Genmutationen problematisch:
- Mutationen von Peptiden des Energiestoffwechsels und der Zellteilung. Nur mit einer funktionierenden Energieversorgung und der Fähigkeit zur Zellerneuerung ist ein Organismus überlebensfähig.
- Mutationen von DNA‑Reparaturpeptiden, die für die Funktionsfähigkeit der Prozesse auf der oberen Zellebene notwendig sind. Gerade hier entsteht ein gefährlicher Teufelskreis, denn die Mutationsrate einer Zelle kann durch fehlende oder fehlerhafte Reparaturmoleküle exponentiell ansteigen.
- Mutationen proteinsyntheserelevanter Peptide‑ beispielsweise defekte Polymerasen ‑ schädigen indirekt auch alle von ihnen abhängigen Enzyme und Proteine, für deren Synthese sie grundlegend sind. Das führt zu einer Primärstörung der Proteinbiosynthese und kann zu niedrigen Syntheseraten bis hin zum totalen Produktionsausfall oder sonstigen Defekten sämtlicher abhängiger Substanzen führen.
- Mutationen ncRNA‑synthetisierender Peptide, denn ncRNA‑Moleküle entfalten ihre Funktionen hauptsächlich als wichtige Modulatoren der Proteinbiosynthese. Kommt es zu einem ncRNA‑Mangel aufgrund fehlender Synthesepeptide und damit zu einer Primärstörung der Proteinbiosynthese, können daraus wiederum zu niedrige Syntheseraten sämtlicher abhängiger Peptide resultieren.
Wenn Mutationen ncRNA‑synthetisierender Peptide besonders problematisch sind, gilt das natürlich erst recht für direkte ncRNA‑Mutationen, denn das führt ausnahmslos zu einer primär gestörten Proteinbiosynthese. Das gilt insbesondere dann, wenn die geschädigten ncRNA an der Synthese besonders vieler oder bedeutender Peptide beteiligt sind, wie folgende Beispiele zeigen:
- Verschiedene ncRNA‑Moleküle ‑ vor allem micro‑RNA oder circular RNA ‑ führen eine unspezifische Genregulation durch, teilweise regulieren einzelne micro‑RNA‑Moleküle mehr als hundert Gene. Dabei kann es zu Modulationsfehlsteuerungen sowohl von Transkriptions‑ als auch von Translationsprozessen kommen. Eine einzige ncRNA‑Mutation kann auf diese Weise die Proteinbiosynthese von mehr als hundert Enzymen und Proteinen massiv behindern, was in der Regel eine Minderproduktion dieser Substanzen bedeutet. (→ Abschnitte 2.2.3 ff.).
- Mutierte snRNA-Codes haben potentiell Spleißfehler und somit strukturelle Peptidschäden zur Folge (→ Abschnitt 3.3.5).
- Sind die für eine korrekte Aminosäurenverkettung maßgeblichen ribosomalen RNA (rRNA) oder Transfer‑RNA (tRNA) geschädigt oder werden sie mit einer zu geringen Zahl transkribiert, können daraus sowohl Peptidstrukturschäden als auch eine Peptidminderproduktion aufgrund zu niedriger Translationsraten resultieren. Mutierte rRNA sind problematisch, da es nur sehr wenige Formen gibt, die jedoch für die Translationsprozesse in hohen Mengen benötigt werden. Wahrscheinlich gibt es nur maximal vier verschiedene rRNA‑Typen. Ohne ausreichend funktionstüchtige rRNA ist eine Zelle nicht überlebensfähig. Die Natur sorgt allerdings vor, indem jeder der maximal vier rRNA‑Codes gleich mehrfach auf der DNA zu finden ist (→ Abschnitt 2.2.2), so dass einzelne Mutationen weniger Schäden anrichten können. Dennoch ist davon auszugehen, dass die rRNA‑Produktion tendenziell mit jeder einzelnen rRNA‑Mutation sinkt ‑ und damit auch die Translationsrate aller Peptide insgesamt.
Zellprozessstörungen können schon nach nur einer Mutation auftreten, aber auch das Ergebnis eines länger andauernden multimutationsbedingten DNA‑Degenerationsprozesses durch Fehleranhäufung sein. Das bedeutet: Im Laufe der Zeit steigt die Wahrscheinlichkeit von Zellprozessstörungen.
Zelluntergang, Tumore oder Karzinome als weitere potentielle Folgen somatischer Mutationen
Nach somatischen Mutationen können Zellen auch verschwinden oder entarten:
- In bestimmten Fällen führen gravierende Mutationen zum programmierten Zelltod, zum Beispiel durch Aktivitäten des Apoptose-Peptids p53 oder von Caspasen (→ Abschnitt 3.3.1). Dazu bedarf es jedoch einer gewissen Schadenhöhe. In bestimmten Fällen kann das ein Segen für den Gesamtorganismus sein, zum Beispiel wenn maligne (Krebs-)Zellen eliminiert werden, die dann keinen größeren Schaden mehr anrichten können (→ übernächsten Absatz). In den meisten Bereichen des Körpers werden fehlende Zellen ersetzt. Aber gerade im Zentralvervensystem ist auch der programmierte Zelltod problematisch, denn in vielen Hirnarealen werden untergegangene Nervenzellen nicht automatisch ersetzt.
- Ebenfalls kann es zur gefährlicheren ‑ weil unkoordinierten ‑ Zell‑Nekrose kommen. Dabei löst sich die Zelle in einem chaotischen Prozess auf, ohne vorher korrekt in ihre Bestandteile zerlegt und abtransportiert zu werden. Eine Zell‑Nekrose provoziert im Gegensatz zur Apoptose Entzündungsreaktionen und vermag auch umliegendes gesundes Gewebe zu schädigen (→ Abschnitt 4.13.6).
- Nach somatischen Mutationen entstehen potentiell maligne (Krebs‑)Zellen oder gutartige Tumorzellen, die in der Regel vom Immunsystem kontrolliert beseitigt werden. Jedoch gelingt dies nicht immer, worauf sich die schadhaften Zellen massiv vermehren und gutartige Tumoren oder Karzinome bilden.
Zelluntergang und Zellentartung können schon nach nur einer Gen‑ oder ncRNA‑Code‑Mutation eintreten, ebenfalls besteht die Möglichkeit dieser Ereignisse nach einem längerfristigen Degenerationsprozess, der mit der Akkumulation von DNA‑Schäden einhergeht.
Natürliche und beschleunigte DNA‑, Zell- und Organalterung
Jeder Mensch ist im Laufe des Lebens mit einer unvermeidlichen Anzahl von Mutationen konfontriert, ausgelöst durch natürliche Mutagene, natürliche Raten von DNA-Veränderungen nach der DNA-Verdoppelung bzw. natürliche Raten physiologischer Mutationen.
Es gibt darüber hinaus weitere Gefahrensituationen, beispielsweise eine übermäßige Fehlerrate bei der DNA-Verdoppelung oder eine höhere Rate physiologischer Mutationen bei einzelnen Menschen. Auch kommen zusätzliche, nicht-natürliche Mutagene in Frage, denen in der Regel nur eine bestimmte Gruppe von Menschen zu bestimmten Zeiten ausgesetzt ist. Das kann zum Beispiel die örtliche Bevölkerung nach einem regional begrenzten Katastrophenfall sein, beispielsweise nach einem Unfall in einem Kernkraftreaktor durch Radioaktivität oder Menschen, die aufgrund zahlreicher medizinischer Eingriffe eine hohe Menge narkotisierender Substanzen verabreicht bekommen haben (→ Abschnitt 4.2.1).
Aus diesen beiden Umständen ‑ durchschnittliche Mutationsrate vs. erhöhter Mutationsrate ‑ ist zu schließen, dass eine natürliche von einer beschleunigten Zell‑ und Organalterung unterschieden werden kann, vorausgesetzt natürlich, dass eine kausale Beziehung zwischen der mutationsbedingten DNA‑Alterung als Ursache und der Zellalterung als Wirkung existiert und mit einer steigenden Rate mutationsauslösender Situationen auch die Anzahl der DNA‑Mutationen steigt:
- Der natürliche Zellalterungsprozess ist das Ergebnis nicht vermeidbarer zellphysiologischer Vorgänge aufgrund natürlich induzierter DNA‑Mutationen, unvermeidlicher Fehler bei der Übertragung von Nukleinsäureinformationen oder einer durchschnittlichen Anzahl physiologischer DNA‑Mutationen. Aus dem natürlichen Zellalterungsprozess resultiert parallel eine natürliche Organalterung.
- Der beschleunigte Zellalterungsprozess ist das Resultat vermehrt induzierter DNA‑Mutationen aufgrund nicht‑natürlicher, zusätzlich Mutagene (Noxen), einer übermäßigen Fehlerrate bei der Übertragung von Nukleinsäureinformationen oder einer erhöhten Anzahl physiologischer Mutationen. Eine schneller ansteigende Zahl von Mutationen hat häufig auch negative Auswirkungen auf die Fähigkeit zur DNA‑Reparatur und damit eine weitere Beschleunigung der DNA‑ und Zellalterung zur Folge. Aus dem beschleunigten Zellalterungsprozess resultiert eine beschleunigte Organalterung.
Langfristige Multiplikatoreffekte als Proteinbiosynthese-GAU
Da mutierte Zellen in der Regel überleben, geben sie ihre fehlerhafte DNA bei der Zellteilung weiter. Ebenfalls steigt die Mutationsanzahl in jeder einzelnen Zelle im Zeitverlauf durch Neumutationen an. Beide Prozesse wirken multiplikativ und verdichten im Laufe der Zeit mutierte prozessgestörte Zellen im betreffenden Organ durch dieses als Fehlerakkumulation bezeichnete Phänomen. Mittel- bis langfristig kommt es zu einer das gesamte Organ umfassenden kontinuierlichen und tendenziell exponentiell ansteigenden Funktionsverschlechterung.
Alle Mutationen verschlechtern kontinuierlich die Proteinbiosynthese durch primäre oder sekundäre Störungen und können langfristig einen zellphysiologischen „Flächenbrand“ auslösen, insbesondere jedoch Mutationen ncRNA- und proteinsyntheserelevanter Gene und ncRNA-Codes, die zu Primärstörungen der Proteinbiosynthese führen.
ABBILDUNG 23: SEKUNDÄRSTÖRUNGEN DER PROTEINBIOSYNTHESE NACH GENMUTATION
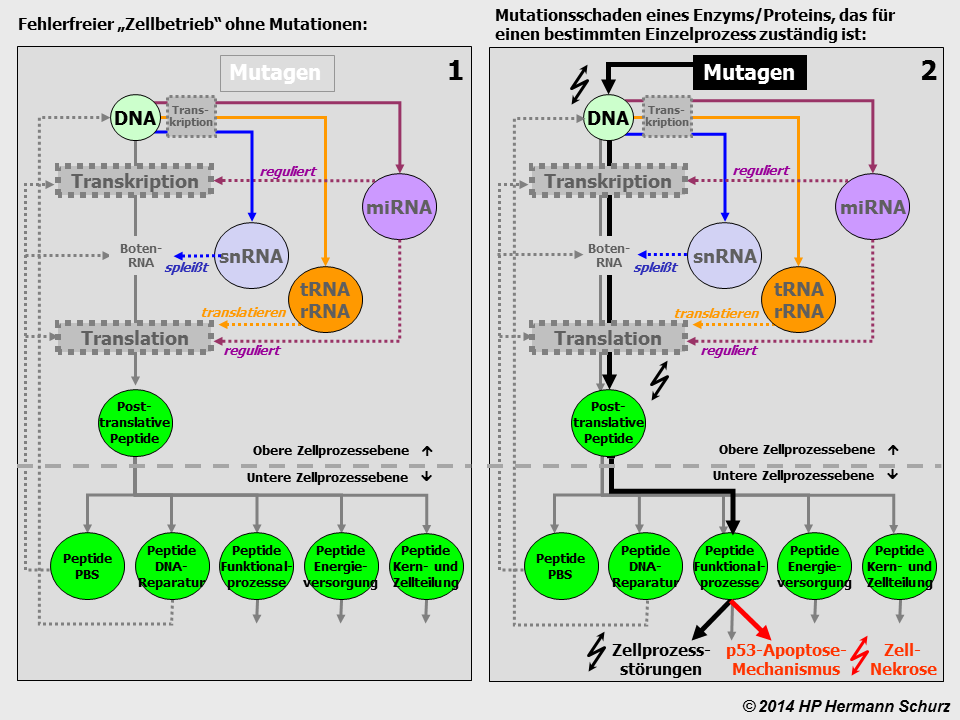
Abbildung 23: Die beiden Graphiken zeigen das Zellprozessmodell in einer vereinfachten Form, im linken Bild (1) noch unversehrt. Auf dem rechten Teil der Abbildung (2) führt ein Mutagen zu einem Genschaden, der einen der unzähligen Funktionalprozesse auf der unteren Zellprozessebene betrifft. Die Auswirkungen werden durch breitere Prozesspfeile und Blitzsymbole in schwarz (Prozessstörungen) bzw. rot (Zelluntergang) symbolisiert.
Die Mutation hat sekundäre Proteinbiosynthesestörungen zur Folge, bei denen das betreffende Peptid nicht mehr mit der üblichen Nukleinsäurenabfolge produziert wird. Handelt es sich um einen sehr schwerwiegenden Fehler, beispielsweise weil der geschädigte Einzelprozess eine sehr große Bedeutung für die Zelle hat, besteht die Möglichkeit der Apoptose (Zelltod). Die Zelle wird geordnet in ihre Einzelteile zerlegt und diese abtransportiert, bevor sie einen größeren Schaden anrichtet. Im Falle der gefährlicheren Nekrose löst sich die Zelle ungeordnet auf und provoziert Entzündungen auch gesunden Nachbargewebes. Verluste von Nervenzellen sind im Zentralnervensystem allerdings problematisch, denn in vielen Arealen ist eine Zellneubildung nicht ohne Weiteres möglich.
Es ist ebenfalls problematisch, wenn ein Zellschaden für den Zelltod nicht ausreicht oder der Apoptose-Mechanismus versagt. Dann manifestiert sich die Mutation in der Zelle bzw. im Organ und wird an die Tochterzellen weitergegeben. So können sich mit der Zeit DNA-Schäden anhäufen, d. h. akkumulieren. Dazu kommen noch Neumutationen, welche die Fehlerakkumulation weiter verstärken.
ABBILDUNG 24: PRIMÄRSTÖRUNGEN DER PROTEINBIOSYNTHESE NACH GENMUTATION

Abbildung 24: Die Mutation betrifft hier ein wichtiges Enzym zur Durchführung der Proteinbiosynthese. Die linke Abbildung (3a) zeigt den ersten mutationsbedingten Effekt. Die Konsequenzen entsprechen zunächst denen, die bei allen Peptiden gelten (→ Abbildung 23), die Mutation wird entweder manifest oder die Zelle stirbt den programmierten Zelltod, womit die Mutation automatisch beseitigt ist. Eine wesentlich schlechtere Alternative ist die Nekrose. In vielen Organen ist ein Zelltod weniger problematisch, da sie über regenerative Potentiale verfügen und Zellen schnell ersetzen. Im Zentralnervensystem ist ein Zelltod jedoch äußerst problematisch, da eine Zellregeneration in vielen Arealen nicht ohne Weiteres möglich ist.
Die rechte Abbildung (3b) zeigt die Implikationen, falls die Zelle trotz Gendefekts weiterbesteht. Die darauffolgende primäre Störung der Proteinbiosynthese hat Auswirkungen auf sämtliche Prozessbereiche.
ABBILDUNG 25: PRIMÄRSTÖRUNGEN DER PROTEINBIOSYNTHESE NACH RNA-MUTATION
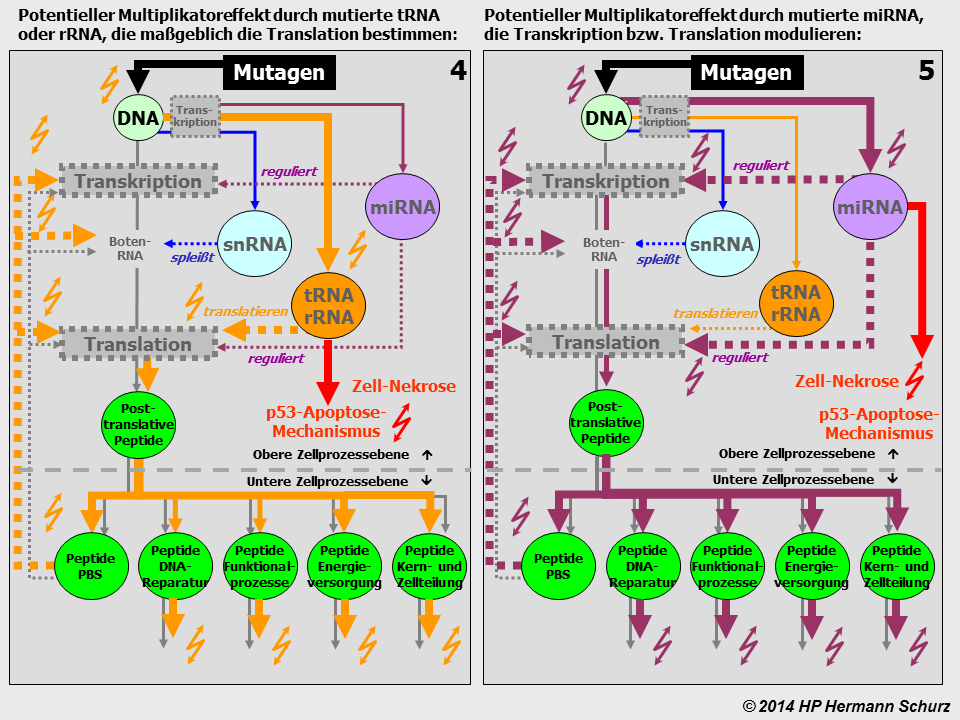
Abbildung 25: Einen vergleichbaren Effekt wie in Abbildung 24 haben ncRNA-Mutationen, denn ncRNA-Moleküle erfüllen ihre Aufgaben ebenfalls ausschließlich im Zusammenhang mit der Durchführung und/oder Modulation der Proteinbiosynthese. tRNA und rRNA sind für den eigentlichen Syntheseprozess an den Ribosomen (Translation) unverzichtbar, während miRNA der Synthesesteuerung bzw. ‑modulation dienen. Daraus resultieren Multiplikatoreffekte auf sämtlichen Prozessbereichen. Diese sind umso größer, je stärker die geschädigten ncRNA-Moleküle in die Proteinbiosynthese involviert sind. Ein miRNA-Molekül, das die Synthese mehrerer hundert Gene steuert, kann im Mutationsfalle erhebliche langfristige Schäden anrichten.
4.2.3 Verschiedene Alterungstheorien
Die Identität von DNA‑ , Zell‑ und Organalterung wurde im vorigen Abschnitt schon postuliert und anhand verschiedener Modelle verifiziert. Welche Ansichten dazu gibt es dazu aktuell in der biologischen bzw. genetisch fundierten Altersforschung?
In allen Disziplinen werden verschiedene Alterungstheorien diskutiert, bei denen die Akkumulation von DNA‑Schäden und daraus resultierende Proteinbiosynthesestörungen im Zentrum stehen und zwischen den Jahren 1956 und 1980 entstanden:
- Die Hypothese der Quervernetzung verschiedener Makromoleküle (Cross-linkage theory of aging) basiert auf den Überlegungen des ungarischen Gerontologie-Pioniers Frigyes Verzár, die er im Jahre 1956 formulierte. Demnach bilden DNA und große Polypeptide im Laufe der Zeit immer mehr Quervernetzungen und sind damit in der Erfüllung ihrer Aufgaben behindert. Vor allem Behinderungen der DNA durch diese unerwünschten Verbindungen führen dann zur Störungen der Proteinbiosynthese.
- Die Theorie der freien Radikale basiert auf einer Theorie des amerikanischen Chemikers Denham Harman. Harman postulierte, dass durch die Verarbeitung molekularen Sauerstoffs (O2) in jeder Zelle Substanzen entstehen, sogenannte „freie Radikale“, die Zellbestandteile schädigen können. Durch freie Radikale seien wichtige Makromoleküle, beispielsweise DNA, RNA, Proteine und Lipide, gefährdet. Im Laufe der Zeit sammele sich immer mehr Zellmüll an, der maßgeblich die Zellalterung vorantreibe. Bei Tierexperimenten stellte er später fest, dass die Lebenserwartung mit der Zufuhr von als Radikalfänger geltenden Mikronährstoffen um 25 bis 40% stieg. Seine Ansichten formulierte er schon im Jahre 1956, den Nachweis mittels Experimenten an Mäusen veröffentlichte er 1976.
- Die Fehler-Katastrophen-Theorie (Error and fidelity theory bzw. Error catastrophe of aging), 1961 formuliert vom englischen Chemiker Leslie Orgel, unterstellt eine zunehmende Potenzierung von Problemen bei der Proteinbiosynthese durch Synthesefehler genau der Peptide, die für die Proteinbiosynthese und die Informationsprozesse zuständig sind. Die Zelle wird im Laufe der Zeit immer mehr überfordert, diese Probleme zu beheben.
- Die von dem am Brookhaven National Laboratory in New York tätigen Biologen Howard Curtis im Jahre 1965 formulierte Mutationstheorie geht davon aus, dass sich im Verlaufe des Alterns die Zahl der Mutationen immer weiter erhöht. Curtis hatte Chromosomenanomalien ‑ auch als Chromosomenaberrationen bezeichnet ‑ in bestimmten Organzellen festgestellt, deren Zahl mit der Zeit anstieg. Er schloss daraus, dass alle Zellen des Körpers diesem destruktiven Prozess ausgeliefert sind und in der Folge dann Erkrankungen entstehen. Über die Ursachen der Chromosomenaberrationen machte Curtis keine Aussagen.
- Die Theorie der DNA-Blockierung durch Histone ist eine Hypothese, die auf einen Teilaspekt der Vorgänge im Zellkern verweist. Sie wurde von dem Gerontologen H. P. von Hahn 1971 formuliert. Ein vermehrtes Auftreten von Histonen soll den Zugriff auf wichtige Gensequenzen verwehren, da sich der DNA-Strang dann nicht mehr richtig entspiralisieren kann und somit eine Transkription vereitelt. Angaben zu den Gründen steigender Histonenanzahl machte von Hahn nicht.
- Die im Jahre 1975 formulierte Fehlerhypothese geht auf den amerikanischen Gerontologen F. Marott Sinex und den sowjetischen Biologen Zhores Medvedev zurück. Die gesamte Proteinbiosynthese wird durch endogen oder exogen beeinträchtige DNA, die im Laufe der Zeit immer mehr Fehler anhäuft (akkumuliert), behindert und produziert immer weniger Proteine, so dass es zu verminderten Zellaktivitäten kommt.
- Die Adaptions-Regulations-Theorie formuliert den Alterungsprozess umfassender, denn neben Störungen der DNA werden auch Umwelteinflüsse und eine programmierte Alterung als Ursachen angenommen. Dabei lenkt die Theorie die Aufmerksamkeit besonders auf die Gene von Regulatorsubstanzen, welche die Proteinbiosynthese steuern. 1975, im Jahr ihrer Veröffentlichung durch den ukrainischen Gerontologen Vladimir V. Frolkis, waren die modulierenden ncRNA noch nicht bekannt, so dass Frolkis vor allem mutationsbedingt fehlerhafte Modulationspeptide als für die Zellalterung verantwortlich verdächtigte.
Für ein genetisches Programm des Alterns („Programmiertes Altern“) gibt es allerdings bis heute keine Nachweise. In der Wissenschaft wird versucht, die Hypothese des programmierten Alterns zu widerlegen. Es ist auch fraglich, warum es sich die Natur so kompliziert machen sollte, denn DNA ist im Zeitablauf genügend schädigenden Einflüssen ausgesetzt, so dass es spezieller „Alterungsprogramme“ gar nicht bedarf.
- Die Theorie gestörter DNA-Reparaturprozesse des amerikanischen Biologen Bernhard Louis Strehler aus dem Jahr 1976 zielt in eine ähnliche Richtung, beschränkt sich aber auf die Vermutung, dass vor allem die mit dem Alter immer unzuverlässiger werdenden Reparaturmechanismen für die Zellalterung verantwortlich sind.
- Auf Bernhard L. Strehler (→ Nr. 8) geht ebenfalls die Hypothese eingeschränkter Zellmatrizen zurück, die er im Jahre 1979 formulierte. Als Zellmatrizen bezeichnet Strehler die Boten-RNA (mRNA), die aufgrund fehlender oder fehlerhaften Transfer-RNA (tRNA) bzw. ribosomaler RNA (rRNA) nicht korrekt abgelesen werden kann. Seine Annahmen beruhen auf einer empirischen Untersuchung, die weiter unten noch beschrieben wird (Quelle: B. L. Strehler, M. P. Chang, Loss of hybridizable ribosomal DNA from human post-mitotic tissues during aging: II. Age-dependent loss in human cerebral cortex-hippocampal and somatosensory cortex comparison, Mechansims of Ageing and Development, 12/1979, Elsevier, https://www.ncbi.nlm.nih.gov/pubmed/...).
- Miquel et al. erweiterten die Altern-durch-freie Radikale-Hypothese von Denham Harmann aus dem Jahre 1957 (→ Nr. 2), indem sie sich vor allem auf Mitochondrien als Hauptverantwortliche für die Entstehung von reaktive Sauerstoff-Spezies (ROS) konzentrierten, die potentiell Schädigungen der mitonchondrialen DNA (mtDNA) verursachen (Quelle: J. Miquel, A. C. Economos, J. Fleming, J. E. Johnson Jr, Mitochondrial role in cell aging, 1980, Experimental Gerontology, Vol. 15 (6), S. 575 ‑ 591, https://www.sciencedirect.com/...).
Quintessenz: Sämtliche Alterungstheorien verweisen auf somatische DNA‑Mutationen und dadurch bedingte Proteinbiosynthesestörungen als zentrale Ursachen für die Alterung von Zellen und Organismen, wobei in jeder Theorie unterschiedliche Schwerpunkte gesetzt werden.
Dass Proteinbiosynthesestörungen die entscheidenden Trigger des Alterungsprozesses sind, ist eine Annahme, die auch aus der Analyse der hier erarbeiteten Modelle abgeleitet wurde (→ Kapitel 2 f.).
Hauptdefizit aller Alterungstheorien: Potentielle Mutationen der ncRNA-Moleküle unberücksichtigt
RNA in der Form von Boten‑RNA, ribosomaler RNA und Transfer‑RNA waren nach der Entdeckung der DNA‑Doppelhelix durch Watson und Crick im Jahre 1953 noch gänzlich unbekannt - man wusste nicht, wie eine Zelle es schafft, die Informationen der DNA in Peptide zu übersetzen. Crick vermutete von Beginn an die Existenz von Molekülen als Mittler zwischen DNA und Peptiden, die dann von Paul C. Zamecnik 1956 als Transfer‑RNA (tRNA) identifiziert wurden. Dass Boten‑RNA überhaupt als Informationsträger fungiert, wurde von Francis Crick erst zwölf Jahre danach im Jahre 1968 postuliert.
Die Möglichkeiten von Mutationen verschiedener ncRNA-Moleküle werden immerhin in zwei Alterungstheorien explizit erwähnt, denn Transfer-RNA (tRNA) und ribosomale RNA (rRNA) waren zur Zeit ihrer Entstehung im Jahre 1979 bekannt und der Vorgang der Proteinbiosynthese schon etwas genauer entschlüsselt; dadurch hatten die beiden Autoren gegenüber den anderen Wissenschaftlern und deren älteren Theorien entscheidende Vorteile:
- Denham Harman sieht auch durch freie Radikale geschädigte RNA-Moleküle als eine zentrale Ursache der Zellalterung und führte im Jahre 1979 Experimente an Tieren durch.
- Berhard L. Strehler benennt ebenfalls im Jahre 1979 ausdrücklich geschädigte oder fehlende rRNA-Moleküle als die wahrscheinlichen Motoren mutativer Prozesse und verweist damit erstmals eindeutig auf nicht-codierende RNA. Strehler untersuchte dabei auch Teile des menschlichen Zentralnervensystems. Weitere Informationen folgen daher in Abschnitt 4.2.4.
Da sämtliche Alterungstheorien aus den Jahren 1956 bis 1980 stammen, können sie naturgemäß aktuelle wissenschaftliche Erkenntnisse nicht berücksichtigen. Das gilt hier insbesondere für die Entdeckungen der Proteinbiosynthesesteuerungsmechanismen mit niedermolekularen (kurzkettigen) ncRNA‑Molekülen, die erst seit der 1998 veröffentlichten Arbeit von Craig Mello und Andrew Fire nach und nach erforscht werden (Quelle: Driver, Fire, Mello et al., Potent and specific genetic interference by double‑stranded RNA in Caenorhabditis elegans, Nature Journal No. 391, 2/1998, http://www.ncbi.nlm.nih.gov/...). Dadurch fehlt allen Alterungstheorien ein wichtiger Baustein zum umfassenden Verständnis und der Erklärung der Auswirkungen mutativer Prozesse.
Ebenfalls wird in den Theorien weder ein Unterschied zwischen natürlichen und beschleunigten Mutationsprozessen gemacht, noch Annahmen über die hinter den DNA-Schäden steckenden Primärursachen getroffen.
Ein modernes Modell der Zell- und Organalterung durch mutative Prozesse
Es liegt daher nahe, die Kernaussagen der einzelnen Theorien, die Ergebnisse der Zellprozessmodellanalysen und die aktuellen Erkenntnisse der RNA-Forschung zu einer moderneren Theorie des Alterns zusammenzufassen:
- Die Alterung von Zellen und Organen beruht zu einem wesentlichen Teil auf somatischen DNA‑Mutationen.
- Verantwortlich für somatische DNA-Mutationen sind endogene oder physiologische Zellvorgänge und/oder Einflüsse exogener Noxen (Mutagene).
- Je stärker und häufiger Zellen im Zeitverlauf mutativen Zellvorgängen oder exogenen Noxen/Mutagenen ausgesetzt sind, desto schneller und intensiver geht der DNA‑Mutationsprozess vonstatten.
- Bei jeder Zellteilung werden bestehende Mutationen auf die Tochterzellen übertragen. Zusätzlich kommt es im Zeitverlauf zu weiteren Neumutationen. Beides führt zu einer zunehmenden Akkumulation ‑ d. h. Anhäufung ‑ von Mutationen in Zellen und Organen.
- Nach einer DNA-Mutation kann es zu einer fehlerhaften Struktur derjenigen Moleküle kommen, deren DNA-Code verändert ist, oder die Moleküle werden nicht mehr in der benötigten Menge synthetisiert.
- Eine Mutation kann endogene Zellprozessstörungen zur Folge haben und in der Konsequenz verschiedene Störungen nach außen gerichteter ‑ exogener ‑ Zellaktivitäten.
- Eine Mutation kann ebenfalls zum Zelltod durch Apoptose oder Nekrose führen. Ebenfalls können Tumor- oder Karzinomzellen entstehen.
- Endogene Prozessstörungen können nach Mutationen unter Umständen bis zu einem bestimmten Punkt durch ausgleichende Zellstoffwechselprozesse verhindert oder abgemildert werden, so dass auch keine nach außen gerichteten Zellaktivitätsstörungen, ein Zelltod oder Tumor- bzw. Karzinomzellen resultieren. Sobald diese Kompensation nicht mehr aufrecht erhalten werden kann, sind Zellaktivitätsstörungen oder Zellentartung allerdings unausweichlich.
- Die DNA enthält neben der Information zum Zusammenbau von Peptiden ebenfalls Informationen zum Zusammenbau nicht‑codierender RNA. DNA‑Mutationen betreffen neben Peptiden daher auch ncRNA‑Moleküle.
- Sind proteinbiosyntheserelevante Peptide oder ncRNA mutiert, können daraus primäre Proteinbiosynthesestörungen* mit multiplikativen Auswirkungen auf sämtliche abhängigen Zellprozesse resultieren.
*) Bei primären Störungen der Proteinbiosynthese können deren Syntheseprozesse Transkription, Translation oder das Spleissen nicht fehlerfrei durchgeführt werden. Bei sekundären Störungen der Proteinsynthese sind es einzelne Peptide, die aufgrund einer Genmutation nicht korrekt produziert werden, wobei hier die eigentlichen Syntheseprozesse störungsfrei ablaufen.
- Auch mutationsbedingte Schädigungen von Molekülen, die direkt oder indirekt am Energiestoffwechsel oder der Kern- und Zellteilung beteiligt sind, können zu massiven multiplikativen Problemen in mehreren Zellfunktionsbereichen führen. Besonders betroffen sind beispielsweise die für die Energieversorgung zentralen Mitochondrien und deren mtDNA.
- Über die Verursachung von DNA‑Schäden hinaus haben einige Mutagene das Potential, auch andere Zellbestandteile zu schädigen, beispielweise innere und äußere Zellmembranen oder Organellen, und treiben die Zell‑ und Organalterung zusätzlich voran.
Mutativ bedingte Alterungsprozesse im Zentralnervensystem unter Berücksichtigung von ncRNA
Das allgemeine Modell mutativer Zell- und Organalterung lässt sich natürlich auch auf Gehirn und Rückenmark übertragen:
- Die Alterung des Zentralnervensystems und seine tendenziell sinkende Leistungsfähigkeit kann auf endogenen und exogen‑induzierten DNA‑Mutationen in allen dort befindlichen Zellarten, wie Neuronen, Glia‑, Bindegewebe‑, Stamm‑ oder Blutgefäßzellen, beruhen. Über die Verursachung von DNA‑Schäden hinaus haben einige Mutagene das Potential, auch andere Zellbestandteile zu schädigen, beispielweise innere und äußere Zellmembranen oder Organellen, und treiben die Zell‑ und Organalterung zusätzlich voran.
- Von somatischen Mutationen sind alle DNA-codierten Moleküle betroffen; neben Peptiden (Enzyme, Proteine) sind das vor allem sämtliche Arten von ncRNA-Molekülen.
- Die Vorgänge können in mutierten Zellen zu zunehmenden Störungen endogener Zellprozesse führen, einschließlich primärer Störungen der Proteinbiosynthese.
- Darüber hinaus können insbesondere Mutationen mit Auswirkungen auf den Energie‑ bzw. Glukosestoffwechsel zusätzlich erhebliche negative Einflüsse haben. Beispielsweise sind Nervenzellen von einem funktionierenden Glukosestoffwechsel besonders abhängig, da sie ihren Energiebedarf ausschließlich mit Glukose decken.
- Hat die DNA‑Schädigung ein bestimmtes Niveau erreicht, kann es auch zum Zelltod durch Apoptose bzw. zur gefährlicheren Zellnekrose kommen. In vielen Hirnarealen können verschwundene Nervenzellen, im Gegensatz zu teilungsfähigen Glia‑ oder Blutgefäßzellen, nicht ohne Weiteres ersetzt werden. Ebenfalls können sich Tumor‑ oder Karzinomzellen bilden, falls mutierten Zellen nicht frühzeitig vom Immunsystem beseitigt werden.
- Mutierte teilungsfähige Zellen übertragen ihre DNA‑Defekte auf nachfolgende Zellen und damit auch auf aus Stamm‑ bzw. Gliazellen neu zu bildende Neuronen. Zusammen mit weiteren Mutationen häufen sich DNA‑Fehler in sämtlichen Zellarten des Gehirns und Rückenmarks weiter an, was auch als Akkumulation bezeichnet wird.
- Die Mutationsprozesse führen zu dem im 3‑Stufen‑Modell beschriebenen Verlauf (→ Abschnitt 1.4). Die Anzahl gesunder Zellen sinkt und immer mehr Nervenzellen können ihre Funktionen, einschließlich der Verknüpfung mit anderen Nervenzellen, nicht mehr aufrecht erhalten. Parallel entsteht durch das zunehmende Absterben von Nervenzellen eine steigende Anzahl mehr oder weniger großer Lücken im Nervengewebe.
4.2.4 Mutationen, Alterungsprozess und (neuro-)degenerative Erkrankungen in der Forschung
In mehreren Forschungsprojekten oder Studien wurden potentielle Zusammenhänge zwischen degenerativen bzw. neurodegenerativen Erkrankungen und mutativen DNA‑Veränderungen untersucht, wobei Affekterkrankungen hier noch keine Rolle gespielt zu haben scheinen.
Dabei haben die Arbeiten (→ Aufzählung unten) keine bestimmten exogenen Mutagene im Fokus. Es wird aus Veröffentlichungen zitiert, die allgemeine Mutationsprozesse erforschen, diese nachweisen oder plausibel beschreiben ‑ unabhängig von potentiellen exogenen Noxen. Aber gerade solche Prozesse könnten sich dann als die Zellschwachstellen entpuppen, die Mutagene als Einfallstore für ihre schädlichen Wirkungen nutzen.
Die Problematik spezieller Mutagene bzw. Noxen und ihrer Wirkungen auf das Zentralnervensystem wird im zweiten Teil des Kapitels untersucht (→ Abschnitt 4.13 f.).
In einigen Arbeiten werden über DNA‑Mutationen hinaus auch oxidative Schäden anderer Zellbestandteile als Motoren der Zellalterung in Gehirn und Rückenmark diskutiert. Beispielsweise ist das Gehirn aufgrund seines hohen Gehalts an mehrfach ungesättigten Fettsäuren durch (Lipid‑)Oxidation stark gefährdet. Solche Schadensszenarien werden in Abschnitt 4.13 diskutiert (→ Abschnitt 4.13.6).
Forschungsschwerpunkt: Mitochondriale Oxidationsschäden
Häufig wird in der Forschung ein besonderer Augenmerk auf einen Anstieg des oxidativen Zellstresses gelegt. Oxidativem Stress ist jede Zelle zu jedem Zeitpunkt ausgesetzt. Einige Alterungstheorien geben oxidativem Stress eine Mit‑ oder sogar Hauptschuld an der Zellalterung (→ Abschnitt 4.2.3). Eine theoretische Grundlage dieser Arbeiten ist daher die Hypothese von Miquel et al. über die Bedeutung reaktiver Sauerstoff‑Spezies (ROS), welche auf der Theorie der freien Radikale von Denham Harman aufbaut (→ Nr. 2 und Nr. 10 oben).
So könnten degenerative Erkrankungen im Zusammenhang mit zunehmender Mitochondrien‑Desorganisation stehen. Mitochondrien sind als Zellkraftwerke für alle Zellprozesse relevant. Da Neuronen ihre Energieversorgung ausschließlich mittels Sauerstoff und Glukose sichern und Mitochondrien im Zentrum dieser Prozesse stehen, stellen mitochondriale Veränderungen gerade für Gehirn und Rückenmark eine ernste Gefahr dar. Als eine der Ursachen der Mitochondrienveränderungen steht das Aufkommen aggressiver Sauerstoffradikaler in Verdacht, das unter anderem Schädigungen der mitochondrialen DNA (mtDNA) zur Folge haben kann. Sauerstoffradikale entstehen stoffwechselbedingt in jeder Zelle zu jedem Zeitpunkt, dazu bedarf es keiner weiteren Stressfaktoren von außen.
Das kleine Genom der Mitochondrien hat nach derzeitigem Wissensstand weniger Schutzmechanismen und verfügt wahrscheinlich auch über weniger Reparaturprozesse als die DNA des Zellkerns. Darüber hinaus ist es besonders stark reaktiven Sauerstoff‑Spezies (ROS), zum Beispiel freien Sauerstoffradikalen, ausgesetzt, da diese vor allem im mitochondrialen Umfeld der Zellatmung entstehen.
Mitochondriale Schäden wurden in folgenden Arbeiten festgestellt:
- In einer Untersuchung wurden altersbedingte Veränderungen an mitochondrialer DNA (mtDNA) in Herzmuskelzellen festgestellt (Quelle: Hanne Karen Warnk, Das Auftreten der 4977 bp Deletion der mitochondrialen DNA in menschlichem Herzmuskelgewebe in Abhängigkeit vom Lebensalter und chronischer Hypoxie, Inauguraldisseration, Institut für Rechtsmedizin der Universität zu Lübeck, Lübeck 2006, http://www.zhb.uni‑luebeck.de/...).
- Auch bei der Amyotrophen Lateralsklerose (ALS), einer degenerativen Erkrankung des motorischen Nervensystems, wurden altersbedingte Veränderungen mitochondrialer DNA festgestellt und abnehmende Enzymaktivitäten gemessen (Quellen: Rosen et al., 1993, Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis, Nature 4/1993 Vol. 362, S. 59 ‑ 62, https://www.ncbi.nlm.nih.gov... und Browne et al., 1997, Superoxide dismutase activity, oxidative damage, and mitochondrial energy metabolism in familial and sporadic amyotrophic lateral sclerosis, J. Neurochem. 61, S. 2322 ‑ 2325, https://www.ncbi.nlm.nih.gov/pubmed/8245985).
Oxidationsschäden der Zell-DNA als eine Ursache neurodegenerativer Erkrankungen?
Aber auch die Zellkern-DNA könnte durch Oxidation gefährdet sein, wie die Arbeit von Tao Lu et al. zeigt (Quelle: Tao Lu, Ying Pan, Shyan‑Yuan Kao, Cheng Li, Isaac Kohane, Jennifer Chan, Bruce A. Yankner, Gene regulation and DNA damage in the ageing human brain, Nature, Vol. 429, S. 883 ‑ 891, 2004, https://www.nature.com/...).
Im Frontalcortex des menschlichen Gehirns sinkt demnach die Transkriptionsrate nach dem 40. Lebensjahr von Genen und damit Enzymen, die wichtige Aufgaben u. a. bei der Nervenzellenverknüpfung spielen und die synaptische Plastizität des Gehirns garantieren.
Laut Studie sind Mutationen der Promotoren‑Codes, also der DNA‑Bereiche, die für das Auffinden eines zu transkribierenden (Protein‑)Gens durch eine Polymerase unbedingt notwendig sind, dafür direkt verantwortlich. Oxidativer Stress in Verbindung mit einer verminderten DNA-Reparatur scheinen dabei als Primärauslöser eine große Rolle zu spielen.
Eine Kausalbeziehung von oxidativem Stress, somatischen Mutationen und einer degenerativen neurologischen Erkrankung, beispielsweise Morbus Alzheimer, konnte mit der Studie nicht nachgewiesen werden, sie liegt aber zumindest im Bereich des Möglichen.
Spielen oxidative Prozesse bei neurodegenerativen Erkrankungen eine besondere Rolle?
Im Zentralnervensystem könnten sich Prozesse rund um die Energieversorgung gegenseitig verstärken mit entsprechenden negativen Auswirkungen:
- Aus den genannten Gründen benötigt insbesondere das Gehirn viel Energie aus Glukose und ist damit auf funktionsfähige Mitochondrien in ausreichender Anzahl angewiesen.
- Zum anderen führt gerade der erhöhte Glukosestoffwechsel in Neuronen zu massivem oxidativen Stress, der insbesondere im Umfeld der Mitochondrien zu schädigen vermag.
Geschädigte RNA-Codes als Ursache neurodegenerativer Erkrankungen?
Bernhard L. Strehler, Urheber zweier Alterungstheorien, fand heraus, dass für die Translation wichtige DNA-Abschnitte mit Codes ribosomaler RNA (rRNA) im Laufe der Zeit in den Zellen verloren gehen. Damit ist Strehler einer der ersten, der Mutationen nicht-codierender RNA mit der Zellalterung in Verbindung bringt (Quelle: B. L. Strehler, M. P. Chang, Loss of hybridizable ribosomal DNA from human post-mitotic tissues during aging: II. Age-dependent loss in human cerebral cortex-hippocampal and somatosensory cortex comparison, Mechansims of Ageing and Development, 12/1979, Elsevier, https://www.ncbi.nlm.nih.gov/pubmed/...).
Stehler und sein Team untersuchten mehrere Areale des Zentralnervensystems, unter anderem Zellen der für Affekte relevanten Hippocampi. Die Proteinsyntheseraten in diesen Hirnarealen sinken altersbedingt immer weiter und führen zu komplexen Zellprozessstörungen, wobei eine Ursache in den mutierten RNA-Codes liegen könnte.
Warum es verstärkt zu Mutationen an RNA-Codes kommt, konnten Strehler und sein Team leider nicht herausfinden; es werden Unzulänglichkeiten des DNA-Reparatursystems vermutet.
Ergebnisse einer aktuellen Übersichtsarbeit der Universität Bonn
In der von Giovanna Cenini (Universität Bonn), Ana lloret und Roberta Cascella im Jahre 2018 erstellten qualifizierenden Übersicht (Review) über 247 wissenschaftliche Quellen, standen ‑ neben Veröffentlichungen über Ursachen und allgemeine Auswirkungen oxidativen Stresses und mitochondrialer Veränderungen ‑ vor allem die Erkrankungen Morbus Alzheimer, Morbus Parkinson und ALS im Mittelpunkt. RNA‑Schäden wurden bei Morbus Azheimer und Morbus Parkinson beobachtet (Quelle: Cenini et al., Oxidative Stress in Neurodegenerative Diseases: From a Mitochondrial Point of View, Oxidative Medicine and Cellular Longevity Vol. 2019, 5/2019, Article ID 2105607, https://www.hindawi.com/journals/omcl/2019...).
Nach Auswertung aller Quellen fassten die Autorinnen zunächst allgemeine Erkenntnisse zusammen, nachfolgend eine Auswahl:
- Neurodegenerative Erkrankungen weisen mehrere gemeinsame Zellmerkmale auf, beispielsweise dysfunktionale Mitochondrien, oxidativen Stress oder die Anhäufung anormal aggregierten Proteinschrotts.
- Mitochondrien sind bedeutende Organellen, die neben der Energieversorgung noch weitere wichtige Funktionen in einer Zelle erfüllen.
- Neuronen, die über eine dem Gesamtorganismus ähnliche Lebensauer verfügen (sollten), reagieren empfindlicher auf die Akkumulation oxidativer Schäden als teilbare Zellen.
- Proteinschrott hemmt die Mitochondrienfunktionen und induziert weiteren oxidativen Stress.
Hier deren zentralen Ergebnisse im Hinblick auf die Alzheimer'sche Erkrankung:
- Bei Morbus Alzheimer gibt es einen Zusammenhang zwischen intra- und extrazellulären Proteinanomalien, insbesondere von Amyloïd-Ablagerungen, und verschiedenen Fehlfunktionen (gestörte synaptische Signalübertragung, Mitochondrien-Dysfunktion, Entzündungen des Nervengewebes oder Neuronenverlust), der teilweise auch einen kausalen Charakter haben könnte und darüber hinaus mit erhöhtem oxidativen Stress verbunden ist, unter anderem mit einer gesteigerten Produktion schädlicher ROS.
- ROS-induzierter Stress scheint einer der wichtigsten Ursachen für die anormale extrazelluläre Aggregation von Amyloïd-Plaques im Falle von Alzheimer zu sein.
- Oxidative und nitrosative Stressmarker sind bei Alzheimer erheblich erhöht. Unter anderem war in mehreren Arealen des Cortex diagnostizierter Alzheimer-Patienten, aber auch von Patienten mit leichteren kognitiven Beeinträchtigungen (Mild cognitive impairment/MCI) der Gehalt an Proteincarbonylgruppen im Vergleich zu altersgleichen Kontrollpersonen postmortal erheblich erhöht.
- Zusammenhänge zwischen Mitochondrien-Dysfunktion und Morbus Alzheimer scheinen eher indirekter Natur zu sein, im Gegensatz zu anderen neurodegenerativen Erkrankungen; sie sind dennoch auffällig.
- Im Falle von Alzheimer wurden Fehlfunktionen vor allem der Mitochondrien in Hippocampuszellen nachgewiesen.
- In den Mitochondrien der Synapsen wurde bei Alzheimerkranken eine mehr als fünfmal höhere Produktion des schädlichen Oxidants Wasserstoffperoxid (H2O2) festgestellt; dies könnte ein Grund dafür sein, dass Neuronen anfälliger als Gliazellen für oxidative Schäden sind und dadurch insbesondere die Plastizität der von Alzheimer betroffenen Gehirne in Mitleidenschaft gezogen werden.
- Es sind schon im Frühstadium sowohl Schäden mitochondrialer DNA (mtDNA) als auch Schäden der Boten-RNA (mRNA) Merkmale Alzheimer-geschädigter Gehirne.
- Es konnte mehrfach nachgewiesen werden, dass Cortex-Neuronen von Alzheimer-Patienten im Gegensatz zu Gesunden eine vergleichsweise hohe Anzahl von mtDNA-Aberrationen aufwiesen, also einen Verlust ganzer DNA-Abschnitte (Deletion).
- RNA-Oxidation kann als ein gesichertes Merkmal von Morbus Alzheimer betrachtet werden, sie wurde postmortal in geschädigten Gehirnen schon im Frühstadium der Erkrankung in verschiedenen Untersuchungen festgestellt. Im Liquor von Alzheimer-Patienten wurde eine fünffach erhöhte Menge oxidierter RNA gefunden.
- Der Spiegel von Antioxidantien ist bei Alzheimerkranken sowohl im Gehirn als auch im peripheren Gewebe verändert und auffallend häufig reduziert, insbesondere scheint das für Veränderungen des Glutathion-Metabolismus, der Peroxiredoxine, der Vitamine C und E und von Selen zu gelten.
- Das als Antioxidans wirkende MitoQ konnte in einem Tiermodell Alzheimer-spezifischen Symptomen, wie kognitivem Verfall, Amyloïd-Ablagerungen, Entzündungen von Mikrogliazellen und dem Verlust von Synapsen, entgegenwirken und die Lebensdauer verlängern.
Morbus Parkinson und Morbus Alzheimer weisen neuropathologisch Parallelen auf. Die degenerativen Vorgänge finden bei Morbus Parkinson vorwiegend im Stamm‑ bzw. Mittelhirn statt und sind durch einen fortschreitenden Abbau der Substantia nigra charakterisiert, desweiteren sind die Basalganglien betroffen. Auch bei dieser neurodegenerativen Erkrankung ist eine krankhafte Proteinaggreation feststellbar, die in einer Ansammlung von als Lewy‑Neuriten bezeichneten Proteinschrotts in den neuronalen Fortsätzen ‑ Axonen bzw. Dendriten ‑ gekennzeichnet ist. Morbus Parkinson kann in eine Parkinson‑Demenz übergehen, die eine von Morbus Alzheimer zu unterscheidende Symptomatik aufweist.
In Bezug auf Neurodegeneration und oxidativen Stress bei Morbus Parkinson fassten die Autorinnen eine Menge Forschungsergebnisse zusammen, hier die wichtigsten:
- Ein Zusammenhang zwischen mitochondrialer Dysfunktionalität ‑ insbesondere zunehmende mtDNA‑Schäden und ein Rückgang der Mitochondrienanzahl ‑ und Morbus Parkinson wurde in mehreren Untersuchungen festgestellt.
- Umweltnoxen verschiedenster Art scheinen durch ihre Toxizität zu mitochondrialen Dysfunktionen in den für Morbus Parkinson typischen Hirnarealen zu führen.
- Postmortal wurden in Nervenzellen der für die Entstehung von Parkinson relevanten Hirnareale erhöhte ROS-Werte festgestellt, was auf erhöhten oxidativen Stress schließen lässt.
- Mitochondriale Dysfunktionalität, ROS-Produktion und der Anstieg oxidativen bzw. nitrosativen Stresses scheint eine Ereigniskaskade zu erzeugen, die Biomoleküle ‑ einschließlich DNA und RNA ‑ schädigt und die Genese der neurodegenerativen Parkinson‑Erkrankung fördert.
- Neben den bekannten Ansammlungen aggregierter Proteine (Lewy‑Neuriten) wurde in Gehirnen Parkinsonkranker postmortal eine erhöhte Proteinoxydation, Proteinglykierung und eine erhöhte Menge Lipidoxydationsmarker festgestellt.
Ein weiterer Fokus der verglichenen Arbeiten lag auf der Amyotrophen Lateralsklerose (ALS), einer zentralnervösen degenerativen Rückenmarkserkrankung, die mit massiven pathologischen Muskulaturveränderungen einhergeht. Die Ursachen der Erkrankung sind noch nicht bekannt, es werden verschiedene Einflussfaktoren diskutiert und sowohl familiäre, d. h. polygenetisch bedingte ALS-Formen (fALS), als auch sporadische Formen (sALS) vermutet.
So konnten bei ca 20% der fALS-Patienten erbliche Mutationen des SOD1-Gens nachgewiesen werden, die Fehlfaltungen des SOD1-Enzyms zur Folge haben. Das SOD1-Enzym hat unter anderen antioxidative Funktionen und es scheint so, als ob diese Fehler zu einem Anstieg des oxidativen Zellstresses führten. Tierversuche mit Mäusen hatten allerdings zu mit diesem Ergebnis widersprüchlichen Resultaten geführt: Die radikale Stummschaltung des SOD1-Gens ging hier nämlich nicht mit neurodegenerativen Prozessen einher. Auch weitere Studien zur Rolle des SOD1-Gens konnten keine einheitlichen Ergebnisse über den Zusammenhang zwischen SOD1-Veränderungen und fALS präsentieren.
Jedoch sind polygenetische bzw. erbliche Aspekte Inhalte des noch folgenden Abschnitts 4.7, daher soll an dieser Stelle nicht weiter auf Fragen im Zusammenhang mit einer möglichen familiären ALS-Form eingegangen werden.
Hier die wichtigsten Erkenntnisse in Bezug auf nicht-familiäre Faktoren, die im Wesentlichen die sALS-Form betreffen, wobei natürlich anzunehmen ist, dass ALS das Ergebnis einer Kombination sowohl familiärer als auch sonstiger Einflüsse sein könnte:
- Oxidative Mitochondrien-Schädigungen wurden sowohl bei sALS-Patienten als auch im Tierversuch nachgewiesen.
- Rückenmark und motorischer Cortex zeigten bei ALS-Kranken erhöhte Mengen oxidierter Proteine und erhöhten nitrosativen Stress.
- In Motoneuronen von ALS-Patienten befanden sich erhöhte Mengen verschiedener veränderter Proteine.
- Ein Zusammenhang von mRNA- und DNA-Veränderungen wurde im Tierversuch an einem ALS-Mausmodell nachgewiesen.
- Über das SOD1-Enzym hinaus wurden im Falle nicht-familiär bedingter Erkrankungen noch verschiedene andere antioxidant wirkende Proteine quantitativ und qualitativ verändert nachgewiesen.
Alter und Affektive Störungen
Es gibt wenige Untersuchungen über einen generellen Zusammenhang zwischen dem Lebensalter und einer Affekterkrankung. Auch mögliche Ursachen und Charakteristiken affektiver Erkrankungen bei älteren und sehr alten Menschen sind kaum erforscht.
Die in Fachkreisen relativ bekannte Berliner Altersstudie (BASE) aus den 1990er Jahren hatte in Bezug auf eine Erkrankung an einer Major Depression keine generelle Zunahme bei älteren Menschen feststellen können, jedoch eine Zunahme im Bereich der leichten oder mittleren Depression. Aussagen über Ursachen altersbedingter Affekterkrankungen ist aus der Untersuchung aber nicht abzuleiten (Quelle: M. Linden, Depression bei Hochbetagten, in: Der Nervenarzt, Springer Medizin Verlag, 1/1998, Berlin, https://link.springer.com/...).
Diesen Ergebnissen der Berliner Altersstudie widersprechen allerdings die Erkenntnisse des Bundesamtes für Statistik über stark steigende Suizide im Alter, die eine höhere Rate der Erkrankung an einer starken Depression bzw. Major Depression im Alter zumindest nahelegen (→ Graphik 4).
Die Beteiligung natürlicher und beschleunigter DNA-Mutationsprozesse im Zeitverlauf ist durch beide Untersuchungen zwar nicht zu belegen, sie ist aber auch nicht auszuschließen und liegt im Bereich des Möglichen.
GRAPHIK 4: RATE DER SELBSTMORDE IN DEUTSCHLAND IN ABHÄNGIGKEIT DES LEBENSALTERS
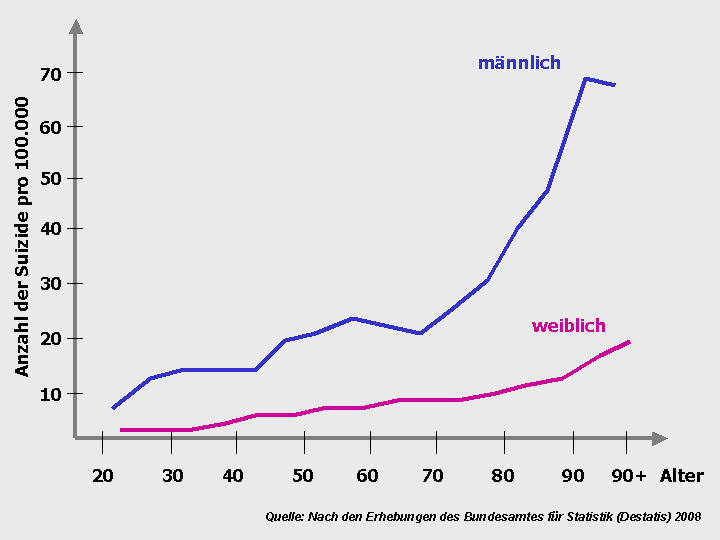
Graphik 4: Zweifelsfrei steigt die Suizidrate mit dem Alter allmählich an und ab dem 70. Lebensjahr ‑ zumindest bei Männern ‑ sogar steil an. Die Suizidrate ist aufgrund mangelhafter Erfassungsmöglichkeiten solcher Ereignisse in der Realität höchstwahrscheinlich sogar ungleich höher, jedoch sind die verschiedenen Einflüsse, die dafür verantwortlich sind, weder zu qualifizieren noch zu quantifizieren. Das Ergebnis widerspricht zumindest nicht der Möglichkeit einer Zunmahme affektiver Erkrankungen im Verlauf des Alterungsprozesses (Quelle: Bundesamt für Statistik, 2008).
4.2.5 Fazit: Somatische DNA-Mutationen und Affektstörungen
Zwar gibt es keine eindeutigen Beweise, ob eine sich im Laufe der Zeit durch Mutationen verändernde DNA zelluläre bzw. organische Alterungsprozesse vorantreibt und solche ‑ falls sie tatsächlich existierten ‑ in der Lage wären, die Entstehung oder Intensivierung neurologisch‑psychiatrischer Erkrankungen und insbesondere Affektiver Störungen zu begünstigen. Es gibt aber empirische Belege dafür, dass sowohl Zellkern‑DNA als auch Mitochondrien‑DNA derartigen degenerativen Veränderungen unterliegen.
Die meisten gerontologischen Alterungstheorien gehen im Kern daher von der plausiblen Annahme aus, dass DNA‑Veränderungen und die damit verbundenen ungünstigen Proteinbiosyntheseveränderungen Hauptursachen von Alterungsprozessen sind.
Unter dem Verdacht, für die DNA-Veränderungen hauptsächlich verantwortlich zu sein, steht oxidativer Stress, einschließlich der Produktion reaktiver Sauerstoff‑Spezies (ROS). Beides entsteht in jeder Zelle zu jedem Zeitpunkt, insbesondere im mitochondrialen Umfeld der Energieversorgung, auch ohne zusätzliche negative Einflüsse von außen. Oxidativer Stress und die ROS-Produktion sind ebenfalls keine Phänomene, die nur auftreten, wenn eine Zelle „auf Hochtouren“ läuft; auch im normalen, eher gemächlichen Zellbetrieb sind sie Realität.
Allerdings korreliert die Höhe des oxidativen Zellstresses mit der Intensität des Stoffwechsels. Da aber gerade in Nervenzellen Energieversorgungsprozesse rund um die Verstoffwechslung von Glukose „auf Hochtouren“ laufen, sind Nervenzellen weitaus stärker als andere Körperzellen oxidativem Stress und ROS ausgesetzt.
DNA‑Veränderungen durch unvermeidbaren und auf natürlichen Prozessen im täglichen Zellgeschehen beruhenden oxidativen Stress werden den als natürlich‑induziert bezeichnenten Mutationen zugeordnet. Zur Kategorie natürlich-induzierter Mutationen gehören ebenfalls physiologische Mutationen ohne erkennbare Ursache.
Auch bestimmte exogene Noxen bzw. Mutagene können oxidativen Stress, die ROS-Produktion und damit die Mutationsrate steigern. Solche exogen-induzierte Mutationen sind von natürlich-induzierten Mutationen zu unterscheiden. Die grundlegenden zellulären Prozesse sind bei beiden Varianten häufig jedoch gleich. Im Teil B des vierten Kapitels werden verschiedene exogene Mutagene und ihre Auswirkungen noch ausführlicher diskutiert.
Affektive Erkrankungen wurden hinsichtlich möglicher Zusammenhänge mit DNA‑Mutationen bisher noch nicht empirisch erforscht. Allerdings wurde bei verschiedenen neurodegenerativen Erkrankungen ‑ beispielsweise Morbus Alzheimer, Morbus Parkinson und der Amyotrophen Lateralsklerose ‑ festgestellt, dass diese mit erhöhtem oxidativen Stress, einer erhöhten ROS‑Produktion und altersbedingten DNA‑Veränderungen in einigen Bereichen des Gehirns und Rückenmarks einhergehen. Das ist ein deutlicher Hinweis darauf, dass derartige Noxen und DNA‑Mutationen bei diesen Nervenerkrankungen miteinander in einem Zusammenhang stehen, wobei kausale Zusammenhang zwar nicht bewiesen werden konnte, aber wahrscheinlich ist.
Interessanterweise wurde bei den Untersuchungen neurologischer Degenerationen bei Morbus Alzheimer ebenfalls festgestellt, dass auch die Hippocampi, eine Region der unteren Großhirnhemisphären, von oxidativem Stress, ROS und DNA-Mutationen betroffen sein können. Daraus kann man schließen, dass bei Affektiven Störungen solche Aspekte ebenfalls eine Rolle spielen. Grund: Die Hippocampi erfüllen wichtige Funktionen bei der Affektverarbeitung (→ Abschnitt 1.3).
Unmittelbare Folgen somatischer Mutationen: Zelltod oder Zellfunktionsstörungen
Der Zelltod tritt meist nach besonders schweren Mutationen auf, die einer Zelle ihre Überlebensfähigkeit nehmen oder die den Organismus durch mutationsbedingt entstandene Krebszellen bedrohen. Es werden zwei Arten unterschieden: die geregelte Apotose und die ungeregelte Nekrose, wobei die Nekrose weitaus höhere Schäden zur Folge hat.
In den weitaus meisten Fällen bedrohen Mutationen aber nicht das Überleben der Zelle, häufig jedoch ihre Funktionsfähigkeit. Zellen überstehen DNA-Schäden, und teilungsfähige Zellen übertragen diese Mutationen von nun an auf ihre Tochterzellen: Die Mutationen bleiben dem Organismus langfristig erhalten.
Da sich im Zeitverlauf durch Mutationen, Mutationsübertragungen auf Tochterzellen und weitere Mutagene DNA‑Veränderungen in Zellen und Organen anhäufen ‑ akkumulieren ‑, kann es zu einem zunehmenden Zellschwund durch Apoptose oder Nekrose und/oder zu immer ausgeprägteren Zellfunktionsstörungen kommen.
Besonders sensible Zellfunktionsbereiche: Proteinbiosynthese, Energieversorgung und DNA-Reparatur
Mutationen proteinsyntheserelevanter Moleküle sind besonders heikel, denn die Eiweißsynthese ist für sämtliche Zellprozesse von grundlegender Bedeutung. Wichtige Moleküle sind beispielsweise Polymerasen, Transkriptionsfaktoren und vor allem proteinsynthesemodulierende ncRNA.
Auch Enzyme und Proteine, die den korrekten Ablauf der Energieversorgungsprozesse steuern, sind funktionsübergreifend wichtig. Ebenfalls gelten Mutationen von Enzymen und Proteinen, die in DNA‑Reparaturprozesse involviert sind, als besonders problematisch, da sie die Fähigkeit einer Zelle zur DNA‑Reparatur immer weiter behindern.
Oxidativer Stress und reaktive Sauerstoff-Spezies (ROS) Hauptursachen der Zellalterung?
Da vieles darauf hindeutet, die Prozesse rund um oxidativen Stress und ROS als eine wesentliche Basis des Zellalterungsprozesses und als Folgen verschiedener Mutagene zu betrachten, sind sowohl deren zugrunde liegenden Mechanismen als auch in Verdacht stehende exogenen Noxen bzw. Mutagene im zweiten Teil des vierten Kapitels in Abschnitt 4.13 zentrale Inhalte.
4.3 Aminosäurenmangel und Affektstörungen ▲
In der Regel spielen Aminosäurenmangelzustände nur untergeordnete Rollen bei der Genese neuro-psychiatrischer Erkrankungen - und zwar aus zwei Gründen:
- Die allgemeine zellphysiologische Relevanz von Aminosäurenmängeln ist nach den Ergebnissen der hier diskutierten Zellprozess- und Kausalanalysen gering (→ Kapitel 3). Es ist aus dieser Sicht unwahrscheinlich, dass ein Aminosäurenmangel eine Nerven- bzw. Affekterkrankung verursacht.
- Darüber hinaus ist in westlichen Ländern in der Regel von einer mindestens moderaten Aminosäurenüberversorgung auszugehen, wohingegen Situationen eher selten sind, die mit einem Mangel einhergehen. Eine Überversorgung kann zum Beispiel die Folge von Ernährungsfehlern oder der Einnahme von Nahrungsergänzungsmitteln sein. Ursachen und Folgen einer Aminosäurenüberversorgung werden nicht im Abschnitt 4.3 thematisiert, sondern hauptsächlich im Abschnitt über die Orthomolekulare Medizin erörtert (→ Kapitel 5).
Dennoch kann es in individuellen Ausnahmefällen zu einer Mangelversorgung kommen, zum Beispiel bei bestimmten Erkrankungen oder Nahrungsdiäten. In Ländern der Dritten Welt hat Aminosäurenmangel sogar eine wesentlich höhere allgemeine Bedeutung aufgrund häufiger überregionaler Versorgungsengpässe.
Daher müssen auch die Ursachen und Folgen eines Amionsäurenmangels bezüglich ihrer speziellen Relevanz bei Erkrankungen des Zentralvervensystems geprüft werden.
4.3.1 Aminosäuren im zentralen Nervensystem
Bei nur 20 Aminosäurenarten liegt die triviale Vermutung nahe, dass jede einzelne für die Proteinbiosynthese unverzichtbar ist. Die Produktion einer immensen Anzahl von Enzymen, Proteinen und Monoaminen kann nur funktionieren, wenn alle Sorten sowohl in der richtigen Menge als auch im richtigen Mengenverhältnis zur Verfügung stehen.
Dennoch haben bestimmte Aminosäuren generell oder in bestimmten Organen eine überproportionale Bedeutung. Beispielsweise sind aufgrund unterschiedlicher Verfügbarkeiten die Anforderungen an die Aufnahme essentieller Aminosäuren höher, da der Körper diese nicht synthetisieren kann.
Tabelle 4 zeigt beispielhaft sowohl allgemeine Aminosäurenfunktionen im Zentralnervensystem als auch spezielle Aufgaben im Zusammenhang mit der Affektverarbeitung (→ Abschnitte 2.3.6 f. für Details). Die Übersicht verdeutlicht, welche Aminosäuren im Gehirn unerlässlich sind und welche im Vergleich eventuell bedeutender sind als andere. Essentielle Aminosäuren sind mit einem Stern (*) markiert.
TABELLE 4: ÜBERSICHT WICHTIGER AMINOSÄURENFUNKTIONEN IM GEHIRN
Aminosäure |
Allgemeine Prozesse im Gehirn |
Prozesse mit einer potentiellen Bedeutung für Affekte |
|---|---|---|
| Isoleucin* | Energieversorgung: Blutzuckerstabilisierung Sauerstoffversorgung: Hämoglobin-Synthese |
Neurotransmitter-Synthese: Acetylcholin Adrenalin Dopamin Gamma-Aminobuttersäure (GABA) Glutamat Glutamin Histamin Noradrenalin Serotonin Hormonhaushalt: Melatonin-Synthese |
| Leucin* | Energieversorgung: Anregung der Insulinproduktion Hormonhaushalt: Senkt Cortisolspiegel Somatropin-Ausschüttung (STH) |
Neurotransmitter-Synthese: Acetylcholin Adrenalin Dopamin Gamma-Aminobuttersäure (GABA) Glutamat Glutamin Histamin Noradrenalin Serotonin Hormonhaushalt: Melatonin-Synthese |
| Valin* | Energieversorgung: Anregung der Insulinproduktion Hormonhaushalt: Ausschüttung von Somatropin (STH) |
Neurotransmitter-Synthese: Acetylcholin Adrenalin Dopamin Gamma-Aminobuttersäure (GABA) Glutamat Glutamin Histamin Noradrenalin Serotonin Hormonhaushalt: Melatonin-Synthese |
| Lysin* | --- | Hormonhaushalt: Melatonin-Synthese Sonstiges: Partieller Antagonist an den 5-HT4-Stressrezeptoren |
| Methionin* | Aminosäuren-Synthese: Cystein Phosphatlipid-Synthese: Phosphatidylcholin |
Neurotransmitter-Synthese: Acetylcholin Adrenalin Dopamin Gamma-Aminobuttersäure (GABA) Glutamat Glutamin Histamin Noradrenalin Serotonin Hormonhaushalt: Melatonin-Synthese |
| Phenylalanin* | Hormonhaushalt: Thyroxin-Synthese (T4) |
Neurotransmitter-Synthese: Adrenalin Dopamin Levodopa Noradrenalin Phenethylamin Tyramin |
| Threonin* | Aminosäuren-Synthese: Glycin Energieversorgung: Aktivierung von Glukosereserven Mikronährstoff-Synthese: Vitamin B12 |
--- |
| Tryptophan* | --- | Neurotransmitter-Synthese: Serotonin (Tryptophan ist die direkte Vorstufe) Acetylcholin Adrenalin Dopamin Gamma-Aminobuttersäure (GABA) Glutamat Glutamin Histamin Noradrenalin Hormonhaushalt: Melatonin-Synthese (entsteht aus Serotonin) |
| Alanin | Energieversorgung: Blutzuckerregulierung |
--- |
| Arginin | Sonstiges: Gefäßerweiterung |
Neurotransmitter-Synthese: Stickstoffmonoxid |
| Asparagin | Sonstiges: Nukleinsäuren-Synthese |
Neurotransmitter-Synthese |
| Asparaginsäure | Sonstiges: Nukleinsäuren-Synthese |
Sonstiges: Neurotransmitterfunktion |
| Cystein | Proteinbiosynthese: Bestandteil aller Peptide Sonstiges: Glutathion-Synthese Aufbau der Zellmembranen |
Sonstiges: Aufbau der Myelinzellmembranen Taurin-Synthese |
| Glutamin | Energieversorgung | Neurotransmitter-Synthese: Glutamat Gamma-Aminobuttersäure (GABA) |
| Glutaminsäure | Energieversorgung: Beteiligung am Glykogen-Stoffwechsel Sonstiges: Antioxidans |
Neurotransmitter-Synthese: Gamma-Aminobuttersäure (GABA) Glutamin |
| Glycin | Energieversorgung: Beteiligung am Glykogen-Stoffwechsel Sonstiges: Nukleinsäuren-Synthese |
Sonstiges: Neurotransmitterfunktion |
| Histidin | Sauerstoffversorgung: Hämoglobin-Synthese |
Neurotransmitter-Synthese: Histamin Glutamat Sonstiges: Myelinzellen-Synthese |
| Prolin | --- |
Sonstiges: Kollagen-Synthese der Gliazellen |
| Serin | Energieversorgung: Beteiligung am Kohlenhydratstoffwechsel |
Phosphatlipid-Synthese: Phosphatidylserin Phosphatidylcholin Neurotransmitter-Synthese: Acetylcholin D-Serin |
| Tyrosin | Hormonhaushalt: T3- und T4-Synthese |
Neurotransmitter-Synthese: Adrenalin Dopamin L-Dopa Noradrenalin Sonstiges: Neurotransmitterfunktion |
Tabelle 4: Jede Aminosäure hat im Zentralnervensystem ihre Bedeutung. In der Tabelle sind wichtige Bereiche erwähnt, daher handelt es sich nicht um eine vollständige Darstellung. Auch ist zu beachten, dass das Wissen über Aminosäurenfunktionen generell noch sehr beschränkt ist. So gut wie alle sind an Prozessen beteiligt, die mit der Entstehung und Verarbeitung von Affekten in einem Zusammenhang stehen. Essentielle Aminosäuren, die unbedingt mit der Nahrung zugeführt werden müssen, sind mit einem Stern (*) gekennzeichnet.
Nach der Tabelle sind 12 Aminosäuren mindestens an folgenden Prozessen direkt beteiligt, die mit der Affektverarbeitung im Zusammenhang stehen könnten:
- Neurotransmitter-Synthese: Adrenalin, Dopamin, GABA, Noradrenalin und Serotonin
- Hormonhaushalt: T3- und T4-Synthese in der Schilddrüse
- Mikronährstoff-Synthese: Vitamin B12
Unter diesen 12 Aminosäuren befinden sich sämtliche essentiellen Aminosäuren (*):
- Isoleucin*
- Leucin*
- Valin*
- Lysin*
- Methionin*
- Phenylalanin*
- Threonin*
- Tryptophan*
- Cystein
- Glutamin
- Glutaminsäure
- Tyrosin
In einem allgemeinen Zusammenhang mit der Affektverarbeitung stehen folgende Basisaktivitäten im Gehirn:
- Die Blutzuckerregulation sichert die Energieversorgung des Gehirns.
- Die Hämoglobinsynthese sichert die Sauerstoffversorgung des Gehirns (und damit die Engergieversorgung).
Zur Durchführung dieser Aktivitäten sind weitere vier Aminosäuren nötig, die damit in einem mittelbaren Zusammenhang mit der Affektverarbeitung stehen:
- Alanin
- Glycin
- Histidin
- Serin
Drei weitere Prozesse sind ebenfalls unentbehrlich (Synthese von Kollagen und Nukleinsäuren, Gefäßdilatation) und stehen mit Affekten in einem weitgehenden Zusammenhang. Zu ihrer Durchführung werden folgende Aminosäuren benötigt:
- Arginin
- Asparagin
- Asparaginsäure
- Prolin
Schon nach wenigen Beispielen wird damit deutlich: Langfristig sind im zentralen Nervensystem ‑ und auch im Zusammenhang mit der Steuerung von Affekten ‑ sämtliche Aminosäuren relevant und unentbehrlich.
4.3.2 Ursachen allgemeiner Aminosäurenfehlversorgungen
Was führt möglicherweise zu einer allgemeinen Unterversorgung mit Proteinen? Folgenden Einflussfaktoren spielen hier eine Rolle:
- langfristige Ernährungsgewohnheiten,
- Erkrankungen, die mit Störungen des Protein- bzw. Aminosäurenstoffwechsels einhergehen oder
- sonstige Umständen, die eine zu niedrige Proteinaufnahme zur Folge haben.
Referenzen für die allgemeine Versorgung mit Aminosäuren
Bevor Gründe und Auswirkungen einer Unterversorgung mit Aminsosäuren erörtert werden, erstmal etwas über die „richtige“ Aminosäurenversorgung, über die es unterschiedliche Ansichten gibt.
Für die tägliche aufzunehmende Proteinmenge sind verschiedene Empfehlungen im Umlauf. Die aktuellste stammt aus dem Jahre 2012 von der Europäischen Behörde für Lebensmittelsicherheit (EFSA). Auch das deutsche Pendant, die Deutsche Gesellschaft für Ernährung (DGE), ermittelt eigene Referenzwerte. Die Empfehlungen beider Behörden weichen bei bestimmten Bevölkerungsgruppen voneinander ab (→ Tabelle 5).
TABELLE 5: PROTEINAUFNAHMEEMPFEHLUNGEN VON DGE UND EFSA
Bevölkerungsgruppe |
DGE (Proteine pro Tag) |
EFSA (Proteine pro Tag) |
|---|---|---|
| Säuglinge bis 12. Lebensmonat | 1,1 bis 2,7 gr/kg Körpergewicht | 1,14 bis 1,31 gr/kg Körpergewicht |
| Kleinkinder bis 4. Lebensjahr | 1,0 gr/kg Körpergewicht | 0,86 bis1,14 gr/kg Körpergewicht |
| Kinder bis 15. Lebensjahr | 0,9 gr/kg Körpergewicht | 0,86 bis 0,92 gr/kg Körpergewicht |
| Jugendliche bis 19. Lebensjahr | 0,9 gr/kg Körpergewicht (Jungen) 0,8 gr/kg Körpergewicht (Mädchen) |
0,83 bis 0,88 gr/kg Körpergewicht (Jungen) 0,83 bis 0,85 gr/kg Köpergewicht (Mädchen) |
| Erwachsene ab 20. Lebensjahr | 0,8 gr/kg Körpergewicht | 0,83 gr/kg Körpergewicht |
| Schwangere | + 58 gr/Tag ab dem 4. Monat | + 1 gr/Tag bis 3. Monat + 9 gr/Tag bis 6. Monat + 28 gr/Tag bis 9. Monat |
| Stillende | + 63 gr/Tag | + 19 gr/Tag bis zum 6. Monat Stillzeit + 13 gr/Tag ab dem 7. Monat Stillzeit |
Tabelle 5: Zwei Ernährungsempfehlungen für Proteine, die vor allem bei Säuglingen, Schwangeren und Stillenden stärker abweichen. Beide Institute werden von Ernährungsexperten allerdings immer wieder kritisiert.
(Quellen: DGE e. V., http://www.dge.de und Europäische Behörde für Lebensmittelsicherheit, http://www.efsa.europa.eu)
Nicht nur die täglich zuzuführende Proteinmenge, auch deren Aminosäurenprofil ist entscheidend für eine ausreichende Versorgung, denn jeder einzelne Aminosäuretyp sollte in der für die Proteinbiosynthese notwendigen Menge bereitgestellt werden.
In diesem Zusammenhang ist der Begriff der biologischen Proteinwertigkeit erläuterungsbedürftig. Diese gibt an, ob ein Protein in Bezug auf die Aminosäurenzusammensetzung dem menschlichen Bedarf für die Proteinbiosynthese entspricht. Eine Proteinart mit der höchsten Wertigkeit von 100 würde alle Anforderungen als Aminosäurenlieferant für den menschlichen Stoffwechsel vollständig erfüllen: Aus 100 Einheiten Nahrungsprotein könnte der menschliche Körper 100 Einheiten körpereigene Proteine synthetisieren.
Eine Wertigkeit größer Null erhalten nur Proteine, die mindestens alle essentiellen Aminosäuren enthalten. Alle anderen haben eine biologische Wertigkeit gleich Null und werden als unvollständiges Protein bezeichnet. Dazu zählt beispielsweise Gelatine, da sie keinerlei Tryptophan enthält.
Proteinwertigkeitsberechnungen orientieren sich meist am Gehalt des Volleis, dessen Aminosäurenprofil mit der Wertigkeit von 100 festgelegt wurde und ein Referenzprotein ist.
Das Berechnungskonzept wird - wie die Empfehlungen bezüglich der täglichen Proteinzufuhr - häufig kritisiert, beispielsweise die Auswahl des Volleis als Referenzprotein oder die Berechnung von Werten über 100, die eine rein mathematische Relevanz haben. Bei der Kombination verschiedener Proteinquellen mit jeweils einer niedrigen biologischen Wertigkeit können rechnerisch hohe Werte mit mehr als 100 erzielt werden. So wird die Kombination Vollei-Kartoffeln mit einer Wertigkeit von 137 belegt. Praktisch ist diese Aussage jedoch sinnlos, denn sie würde bedeuten, dass der Körper in der Lage wäre, aus 100 Gramm Nahrungsprotein 137 Gramm körpereigenes Protein herzustellen. Außerdem wird oft nicht darauf hingewiesen, wieviel Mengen jeweils kombiniert werden müssen. Die Gesellschaft für Ernährungsforschung weist darauf hin, dass zur Erzielung des fiktiven Wertes von 137 ein Ei mit 600 Gramm Kartoffeln kombiniert werden müsste.
TABELLE 6: REFERENZPROTEIN VOLLEI UND VERSCHIEDENE AMINOSÄURENPROFILE
Aminosäure pro 100 Gramm |
Vollei (Referenz) | Milchprotein (Casein) |
Molkenprotein (Whey protein) |
Fleisch | Soja- bohne |
Gelatine |
|---|---|---|---|---|---|---|
| Methionin, Cystein | 6,8 gr |
3,5 gr |
5,3 gr |
4,0 gr |
2,6 gr |
0,9 gr |
| Lysin | 7,4 gr |
8,6 gr |
11,3 gr |
8,9 gr |
6,2 gr |
4,1 gr |
| Threonin | 5,0 gr |
4,4 gr |
6,6 gr |
4,6 gr |
3,8 gr |
2,0 gr |
| Tryptophan | 1,6 gr |
1,7 gr |
2,2 gr |
1,1 gr |
1,3 gr |
0,0 gr |
| Valin | 7,0 gr |
7,4 gr |
6,8 gr |
5,0 gr |
4,8 gr |
2,4 gr |
| Isoleucin | 5,8 gr |
5,9 gr |
7,5 gr |
4,6 gr |
4,7 gr |
1,7 gr |
| Leucin | 8,7 gr |
10,1 gr |
12,0 gr |
8,1 gr |
8,0 gr |
3,1 gr |
| Phenylalanin, Tyrosin |
10,3 gr |
11,8 gr |
11,3 gr |
8,0 gr |
9,0 gr |
3,3 gr |
| Biologische Wertigkeit | 100 |
~ 77 |
100 |
~ 70 - 83 |
~ 84 |
0 |
Tabelle 6: Proteingehalt und biologische Wertigkeit des Volleis im Vergleich mit verschiedenen Proteinquellen. Gelatine ist ein Beispiel für ein unvollständiges Protein, denn es enthält nicht alle essentiellen Aminosäuren, in ihrem Falle fehlt Tryptophan.
(Quelle: Gesellschaft für Ernährungsforschung e. V., http://www.gfe-ev.de
)
Die Aminosäurenversorgung bei verschiedenen Ernährungsgewohnheiten
Nahrung ist die wichtigste Aminosäurenquelle. Damit sind vor allem Nahrungsverfügbarkeit und individuelle Ernährungsweisen für die Aminosäurenversorgung verantwortlich. Es ist zu prüfen, ob die Versorgung in Bezug auf Proteinmenge und Aminosäurenzusammensetzung gefährdet ist:
- in Situationen genereller längerfristiger Mangel- oder Fehlernährung,
- bei Ernährung mit Mischkost,
- bei vegetarischer Ernährungsweise,
- bei veganer Ernährungsweise und
- bei bestimmten Diätformen.
Bei Mangel- und Fehlernährung kommt es zwangsläufig zum allgemeinen Proteinmangel. In westlichen Ländern ist meist eine zu geringe Nahrungsaufnahme aufgrund von Hungerkuren oder unsachgemäß durchgeführter Diäten die Ursache. In Entwicklungsländern führt Nahrungsmittelknappheit meist zu einem erheblichen Proteinmangel.
Beim großen Teil der Mischköstler, die sowohl pflanzliche als auch tierische Produkte essen, ist die Proteinversorgung laut Max-Rubner-Institut und dessen Studie aus dem Jahre 2008 um das 1,5 fache übererfüllt. Voraussetzung ist selbstverständlich die Vermeidung einer einseitigen, auf wenige Nahrungsmittel basierenden Ernährung. Ebenfalls sollten die Lebensmittel qualitativ höher- und vollwertig sein (Quelle: BM für Ernährung, Landwirtschaft und Verbraucherschutz/Max-Rubner-Institut, Nationale Verzehrsstudie II, Ergebnisbericht, Teil 2, Bonn/Berlin 2008, https://www.bmel.de/...).
Der Vegetarismus soll am Beispiel des beliebten Ovo-Lacto-Vegetarismus erörtert werden. Ovo-Lacto-Vegetarier verzehren pflanzliche Lebensmittel, zusätzlich auch Milchprodukte und Eier. Der Konsum von Fleisch und Fisch wird abgelehnt. Damit entfallen zwei wesentliche Proteinquellen, die bei der Durchschnittsbevölkerung den Proteinbedarf hauptsächlich decken.
Getreide, Nüsse, Obst, Salat und Gemüse haben ‑ bis auf wenige Ausnahmen ‑ einen geringeren Proteinanteil und deren biologische Wertigkeit ist ebenfalls reduziert. Ovo-Lacto-Vegetarier gleichen diese Mängel durch den Konsum von Eiern und Milchprodukten aber gut aus, die einen hohen Proteinanteil haben, der in der Regel auch alle essentiellen Aminosäuren enthält und eine hohe biologische Wertigkeit besitzt. Bei einer abwechslungsreichen ovo-lacto-vegetarischen Ernährungsweise besteht eher keine Proteinmangelgefahr. Auch die Ergebnisse der Nationalen Ernährungsstudie II weisen darauf hin, dass bei einer ausgewogenen vegetarischen Ernährung mehr Eiweiß aufgenommen wird als notwendig, so das Ovo-Lacto-Vegetarier Mischköstlern gleichgestellt sind.
Anders sieht es bei Veganern aus, denn diese lehnen auch den Verzehr von Milchprodukten und Eiern ab. In einer Studie aus dem Jahre 2003, die sich mit der Nährmittelversorgung von Veganern in Deutschland beschäftigte, wurde eine Unterversorgung sowohl bei Männern als auch Frauen festgestellt. Im Schnitt unterschritten mehr als ein Drittel der untersuchten Personen die Richtwerte für die Proteinzufuhr. Eine systematische Auswertung der Deutschen Vegan Studie findet man in einer Dissertation, die an der Chemischen Fakultät der Leibnitz Universität Hannover erarbeitet wurde (Quelle: A. Waldmann, Einfluss der veganen Ernährung auf den Gesundheits- und Ernährungsstatus, Ergebnisse der Deutschen Vegan Studie, Fachbereich Chemie der Universität Hannover, Hannover 2005, https://www.deutsche-digitale-bibliothek.de/...), Auch die 2003 durchgeführte englische EPIC‑Oxford‑Studie ergab, dass Veganer deutlich weniger Protein aufnehmen als gewünscht.
Obwohl die Studien ihre Schwächen haben, beispielsweise ist die Relevanz von Richtwerten fraglich, weisen deren Ergebnisse dennoch darauf hin, dass eine vegane Ernährung zu Mangelerscheinungen führt, die sich langfristig auch im Nervensystem negativ bemerkbar machen könnte. Jedoch ist es auch einem Veganer möglich, Proteine in ausreichender Menge und Aminosäurenzusammensetzung aufzunehmen, dazu bedarf es jedoch einer besonders bewussten veganen Ernährungsweise, die wahrscheinlich nur von einem Teil der Veganer beachtet wird.
Auch jede der zahlreichen Diätformen muss hinsichtlich potentieller Proteinmängelzustände analysiert werden.
Chronische Erkrankungen, die mit einem generellen Aminosäurenmangel einhergehen
Auch durch Erkrankungen kann es langfristig zu einem allgemeinen Eiweißmangel kommen. Krankheitsbedingte Gründe eines generellen Proteinmangels können eine zu geringe Eiweißzufuhr oder ein ständiger Eiweißverlust durch die von Erkrankung betroffenen Organe bzw. eine mangelhafte Verarbeitung und Aufnahme des Proteins im Magen-Darm-Trakt sein. Dabei versteht man unter Malabsorption die ungenügende Aufnahme von Nährmitteln aus dem Speisebrei und bei der Maldigestion spaltet der Körper das Protein nicht genügend auf.
Bei Tumorerkrankungen und chronischen Infektionskrankheiten liegt ein gesteigerter Eiweißabbau durch Cytokine vor. Cytokine werden bei diesen Erkrankungen vermehrt gebildet. Gleichzeitig ist der Proteinbedarf dieser Patienten generell erhöht, so dass ihre Versorgung gleich doppelt gefährdet ist.
Bei den nachfolgend aufgezählten chronischen oder malignen Erkrankungen sind Proteinmangelgefahren besonders hoch. Darüber hinaus gibt es natürlich weitere Krankheiten mit derselben Problematik, die hier aus Platzgründen nicht genannt sind. Daher sollte man sich immer ein individuelles Bild über die Situation machen.
- Nierenerkrankungen führen zu Eiweißverlusten
- Glomerulonephritis
- Niereninsuffizienz bzw. Nephrotisches Syndrom
- Durchführung der Hämodialyse bei Niereninsuffizienz
- Erkrankungen des Magen-Pankreas-Darm-Systems durch Malabsoption und/oder Maldigestion
- Entzündliche Darmerkrankungen: Morbus Crohn, Eosinophile Gastroenteritis oder Zöliakie/Sprue
- Polyposis
- Exokrine Pankreasinsuffizienz, beispielsweise bei chronischer Pankreatitis, führt zur Maldigestion
- Sonstige körperliche oder infektiöse Erkrankungen
- Mukoviszidose führt hauptsächlich zur Maldigestion durch die Behinderung der Pankreastätigkeit
- Chronische Infektionen führen zu erhöhtem Proteinabbau bei parallel nicht ausreichender Eiweißzufuhr
- Maligne Erkrankungen
- Tumor- und Karzinomerkrankungen führen zu einem erhöhten Proteinabbau und Proteinbedarf
- Chemotherapie- oder Bestrahlungsphasen gehen häufig mit einer zu geringen Eiweißzufuhr einher
- Appetitlosigkeit bei Krebs führt zu unzureichender Proteinaufnahme
- Psychische/psychiatrische Erkrankungen haben häufig eine zu geringe Eiweißzufuhr zur Folge
- Anorexia nervosa (Magersucht)
- Depression
- Manie und manisch-depressive Symptomatik
- Schizophrenie
- Sonstige Erkrankungen mit häufig zu geringen Eiweißzufuhr
- Geistige Behinderung
- Intelligenzminderung
- Suchterkrankungen, insbesondere Alkoholismus
Interessant sind hier insbesondere Affektstörungen. Verschiedene Depressionssymptome oder manische Zustände führen oftmals zu einer reduzierten Nahrungsaufnahme, vor allem wenn die erkrankten Menschen alleine leben, was häufig der Fall ist: Appetitlosigkeit, Antriebslosigkeit, übersteigerte Aktivität, fehlendes Hungergefühl oder Bettlägerigkeit. Zumindest bei einer schon bestehenden Affektstörung ist die Gefahr eines erkrankungsverstärkenden Effekts aufgrund der zusätzlichen Belastung durch Aminosäurenmangel gegeben.
Sonstige Situationen und Erkrankungen mit generellen Aminosäurenmangelzuständen
Neben Ernährungsweise und chronischen Erkrankungen können weitere Umstände zu langfristigen Fehlversorgungen mit Proteinen bzw. Aminosäuren führen. Dabei spielen ebenfalls Malabsorption, Maldigestion, Mangelzufuhr oder Mehrbedarf eine Rolle. Zum allgemeinen Aminosäurenmangel kommt es potentiell bei...
- verminderter Nahrungsaufnahme alter bzw. hochbetagter Menschen,
- verminderter Nahrungsaufname in Notsituationen (obdachlose Menschen, Verwahrlosung),
- verminderter Nahrungsaufnahme und überproportionalem Bedarf bei Akuterkrankungen,
- Bandwurmbefall durch Malabsorption,
- ungenügende Proteinspaltung durch Vitamin-B-Mangel (Maldigestion),
- vermehrtem Bedarf in der Schwangerschaft und in der Stillzeit (→ Tabelle 5),
- vermehrtem Bedarf in der Kindheit bis zum Abschluss der Wachstumsphase oder
- vermehrtem Bedarf bei Sportlern oder stark körperlich tätigen Menschen.
4.3.3 Fehlversorgungen einzelner Aminosäuren am Beispiel von Tryptophan
Theoretisch sind Aminosäurenmangelzustände denkbar, die Frage ist jedoch, wie wahrscheinlich und relevant sie sind.
Sehr gut lässt sich das exemplarisch an der essentiellen Aminosäure Tryptophan erörtern. Tryptophan ist vor allem als Ausgangssubstanz für den Neurotransmitter Serotonin und das Epiphysen-Hormon Melatonin notwendig, bei denen ein Zusammenhang mit der Steuerung von Stimmungslage und Affekten vermutet wird.
Das Tryptophanvorkommen in der Nahrung und der tägliche Tryptophanbedarf sind eher gering.
Der DocMedicus-Verlag gibt folgende Nahrungsmittel mit einem besonders hohen Gehalt an Tryptophan an:
fast alle Getreidesorten, Hülsenfrüchte einschließlich Sojabohnen, Samen und Nüsse, Speisequark, verschiedene Käsesorten, Ei, Geflügelfleisch, Rindfleisch, Schweinefleisch, Hasenfleisch, zahlreiche Fischsorten und Erdnüsse (Quelle: www.vitalstoff-lexikon.de/tryptophan).
Da diese Lebensmittel bzw. Teile davon sowohl bei Mischköstlern als auch Vegetariern oder Veganern auf dem Speiseplan stehen (sollten), ist eine isolierte Tryptophan-Unterversorgung bei ausgewogener Ernährung nur schwer vorstellbar und in Ländern nördlicher Breitengrade daher eher vernachlässigbar. Es ist keine Studie bekannt, die einen Tryptophanmangel bei vollwertiger Ernährung nachweist.
Bei Personen, die sich einseitig und/oder mit qualitativ minderwertigen Lebensmitteln ernähren, kann es allerdings zu Tryptophanmangelerscheinungen kommen, was in Ländern nördlicher Breitengrade eher vernachlässigbar ist. Es ist keine Studie bekannt, die einen allgemeinen Tryptophanmangel bei vollwertiger Ernährung nachweist.
Eine Ausnahme bildeten allerdings sehr lange Regionen mit Mais als Hauptnahrungsquelle. Der tryptophanarme Mais verbreitete sich nach seiner Entdeckung im Stammland Mexiko im Laufe der Zeit in weite Gebiete Nordamerikas, Südeuropas und Afrikas. In einigen Gegenden Afrikas ist einseitig hoher Maiskonsum und damit einhergehender Tryptophanmangel noch heute ein Problem.
Es muss auch kein ernährungsbedinger Tryptophanmangel vorliegen, um eine Unterversorgung herbeizuführen, wie die weiteren Beispiele zeigen.
So geht eine Unterversorgung mit Vitamin B3 (Niacin) meist mit einem relativen Tryptophanmangel einher. Die B3‑Unterversorgung führt dazu, dass der Körper Niacin selber synthetisieren muss, wozu er erhebliche Tryptophanmengen benötigt, die dann bei allen anderen tryptophanabhängigen Prozessen im Nervensystem fehlen (→ ausführliche Erläuterung in Kapitel 2).
Ein Mangel an Vitamin B6 (Pyridoxin) kann zu einer vermehrten Ausscheidung von Tryptophan, Methionin und Glycin führen.
Auch bei der Einnahme bestimmter Medikamente (beispielsweise Phenytoin oder Reserpin) kann es zur Tryptophanunterversorgung kommen. Diese Situationen sind ebenfalls äußerst selten und im Normalfall nicht relevant.
Ein weiterer Aspekt einer relativen Tryptophanunterversorgung ist die Verbindung zwischen Insulin und der Menge an Serotonin in den serotonergen Nervenzellen. Die Ausschüttung von Insulin erfolgt hauptsächlich im Zusammenhang mit der Aufnahme von Kohlenhydraten und wird im entsprechenden Abschnitt thematisiert (→ Abschnitt 4.8).
Eine der Aufgaben des Insulins ist es aber auch, in den Nervenzellen für die Aufnahme des Tryptophans zu sorgen. Verfügen die Nervenzellen über genügend Tryptophan, kurbelt das entsprechend die Serotoninproduktion an.
Damit können zwei Implikationen verbunden sein: Erstens eine verstärkte Serotoninproduktion nach dem Genuss von Kohlenhydraten durch die höhere Insulinausschüttung, was die Stimmungslage positiv beeinflusst oder zweitens ein gesteigerter Bedarf nach Kohlenhydraten bzw. Süssigkeiten bei schlechter Laune, depressiven Verstimmungen oder einer Depression, mutmaßlich (mit-)ausgelöst durch einen Tryptophanmangel. Beide Reaktionsmuster werden in Literatur und Praxis diskutiert.
Ein Tryptophanmangel kann auch bei einem Überangebot anderer Aminosäuren vorkommen, denn Aminosäuren konkurrieren gegenseitig um die Überwindung der Blut-Hirn-Schranke. Gerade Tryptophan wird tendenziell von anderen im Überfluss vorhandenen Aminosäuren verdrängt.
4.3.4 Studienlage: Aminosäurenmangel und Affektstörungen
Zwar gibt es eine Menge Studien über die Zusammenhänge zwischen Ernährung und Affekten bzw. affektiven Erkrankungen, leider jedoch sehr wenig über Auswirkungen einer isolierten Mangelernährung mit Eiweiß bzw. einzelnen Aminosäuren.
Ein möglicher Zusammenhang zwischen einer Depression oder depressiven Verstimmung und Tryptophanmangel war Untersuchungsgegenstand einer Studie von Wim J. Riedel vom Gehirn-Verhaltens-Institut der Universität Maastricht in den Niederlanden (Quelle: Tineke Klaassen, Wim J. Riedel et al., 1998, Mood effects of 24-hour tryptophan depletion in healthy first-degree relatives of patients with affective disorders, Biologic Psychiatry, 8/1999, Elsevier, Amsterdam 1999, http://www.biologicalpsychiatryjournal.com/...). Er wies nach, dass eine Absenkung des Tryptophanspiegels bei 50% der gesunden Probanden mit familiärer Vorbelastung zu einer depressiven Verstimmung führt. Bei nicht vorbelasteten Probanden waren es nur 9%.
Bei den folgenden Studien geht es zwar nicht um eine Proteinmangelernährung, es werden jedoch andere interessante Zusammenhänge zwischen der Protein- bzw. Aminosäurenaufnahme und einer Depression untersucht.
Eine Ernährungsstudie von Larry Christensen und Sharia Somers aus dem Jahre 1996 kam zu dem Ergebnis, dass depressionsfreie Probanden mehr Proteine und weniger Kohlenhydrate verzehren als depressiv erkrankte Studienteilnehmer (Quelle: L. Christensen, S. Somers, Comparison of nutrient intake among depressed and nondepressed individuals, International Journal of Eating Disorders, 20/1, 7/1996, S. 105 ‑109, Wiley Online Library, Wiley-Blackwell, New York/USA 1996, http://onlinelibrary.wiley.com/...). Die Untersuchung hat aufgrund ihres unzureichenden Studien-Designs allerdingseine niedrige Evidenz, es wurden nur 58 Teilnehmer an drei Tagen untersucht.
In einer Studie unter der Leitung von Rob Markus wurden im Jahre 2000 Zusammenhänge zwischen Ernährung und Depression bei Stress untersucht (Quelle: R. Markus et al., Effects of food on cortisol and mood in vulnerable subjects under controllable and uncontrollable stress, Physiology & Behavior, Vol. 70, Iss. 3 ‑ 4, 8‑9/2000, S. 333 ‑ 342, Amsterdam 2000, http://sciencedirect.com/...). Bei der Gruppe Stressanfälliger führte eine kohlenhydratreiche ‑ aber proteinarme ‑ Ernährung zu weniger depressiver Symptomatik. Ebenfalls stieg bei den Teilnehmern dieser Gruppe der Tryptophanspiegel im Plasma um 42% an, einhergehend mit einer gesteigerten Serotoninproduktion. Die Menge verfügbarer Aminosäuren müsste demnach noch von anderen Faktoren abhängen, als nur von der Menge verzehrten Proteins, beispielsweise von der Menge gleichzeitig aufgenommener Kohlenhydrate. Dies könnte mit dem oben beschriebenen Insulinmechanismus in einem Zusammenhang stehen, der für den Tryptophantransport in die serotonergen Nervenzellen verantwortlich ist.
Es ist bekannt, dass Kohlenhydrate die Proteinaufnahme im Körper fördern. Ist das Verhältnis von Kohlenhydraten und Protein in der Nahrung zu gering, kann die Proteinaufnahme behindert werden.
Auch diese Studie hat aus wissenschaftlicher Sicht leider eine relativ geringe Evidenz, beispielsweise wegen der zu geringen Studienteilnehmerzahl.
Eine Verminderung von Depressionssymptomen bei einer individuellen Zufuhr von Aminosäuren konnte Jürgen Spona von der Universitätsfrauenklinik Wien nachweisen (Quelle: Gesellschaft für Ernährungsforschung vom 3.3.2005). Mittlerweile vermarktet Jürgen Spona sein Konzept als Nahrungsergänzung unter dem Namen Vitalogic, was teilweise kritisiert wurde.
4.3.5 Fazit: Proteinmangel und Affektstörungen
Wurden Aminosäuren schon bei der Zellprozessanalyse als allgemein zellphysiologisch geringrelevant eingeschätzt (→ Abschnitt 3.4), sprechen die Ergebnisse der ‑ wenigen ‑ Studien auch im Zusammenhang mit Erkrankungen des Zentralnervensystems und Affekten nicht dafür, dass diese Bewertung teilrevidiert werden muss.
Das gilt auf jeden Fall für die Bewohner westlicher Ländern und bei ansonsten gesunden Patienten. Hier sind Ernährungsprobleme aufgrund einer optimalen Versorgungslage selten und betreffen eher Menschen, die sich wenig bewusst ernähren oder aus anderen Gründen eine ausreichende Proteinversorgung vernachlässigen. In wenigen Ausnahmefällen kann eine Aminosäurenmangelversorgung jedoch langfristig Probleme bereiten.
Hier eine Zusammenfassung der wichtigsten Erkenntnisse:
- Ein ursächlicher Zusammenhang zwischen Affekterkrankungen und einer Aminosäurenmangelversorgung ist prinzipiell möglich, da sämtliche Aminosäuren für die Funktionsfähigkeit des Zentralnervensystems von Bedeutung sind, und die meisten bei der Steuerung von Affekten bzw. Affektstörungen sogar eine unmittelbare oder zumindest mittelbare Funktion haben.
- Für die tägliche Aufnahme von Protein gibt es relativ zuverlässige Empfehlungswerte hinsichtlich der Menge und des Aminosäurenprofils, die in Einzelheiten leicht voneinander abweichen. Eine ausreichende Proteinversorgung und Proteinqualität ist nach diesen Richtwerten in Ländern der ersten Welt bei ausgewogener Ernährung im Normalfall sichergestellt.
- Auf eine ausreichende Versorgung mit essentiellen Aminosäuren im Allgemeinen und Tryptophan im Besonderen sollte generell geachtet werden.
- In Ausnahmefällen kann es zu einer Aminosäurenunterversorgung kommen; hier spielen in der Regel eine Erkrankung oder besonders ungünstige Lebensumstände eine Rolle (→ nachfolgende Aufzählung).
- Die Studienlage über Zusammenhänge zwischen Aminosäurenmängeln und Affektstörungen ist dürftig.
Folgende Umstände bergen die Gefahr einer generellen Aminosäurenunterversorgung:
- Nahrungsmittelknappheit, beispielsweise in Entwicklungsländern.
- Einseitige Ernährung, Diäten oder Hungerkuren durch ungenügende Eiweißaufnahme.
- Vegetarismus und insbesondere Veganismus durch ungenügende Eiweißaufnahme.
- Chronische Erkrankungen der Nieren durch Eiweißverluste.
- Chronische Magen-Darm-Erkrankungen durch Malabsorption oder Maldigestion.
- Chronische Pankreatitis und Mukoviszidose durch Maldigestion.
- Tumorerkrankungen durch eine ungenügende Aufnahme und erhöhten Abbau von Eiweißen.
- Chronische Infektionen (z. B. HIV, Hepatitiden) durch geringe Eiweißaufnahme und erhöhten Abbau.
- Während Bestrahlungs- oder Chemotherapiephasen durch ungenügende Eiweißaufnahme.
- Akut Erkrankte wegen zu geringer Eiweißzufuhr bei überproportional höherem Eiweißbedarf.
- Bei Bandwurmbefall aufgrund von Malabsorption.
- Mangel an Vitaminen des B-Komplexes durch Maldigestion.
- Bestimmte psychische Erkrankungen durch ungenügende Eiweißaufnahme.
- Suchterkrankungen durch ungenügende Eiweißaufnahme, insbesondere Alkoholismus.
- Geistige Behinderungen bzw. Intelligenzminderungen durch ungenügende Eiweißaufnahme.
- Alte bzw. hochbetagte Menschen durch eine ungenügende Eiweißaufnahme.
- Bei Obdachlosigkeit oder Verwahrlosung durch eine ungenügende Eiweißaufnahme.
- Heranwachsende, Schwangere, Stillende und Sportler wegen des erhöhten Eiweißbedarfs.
Folgende Umstände bergen die Gefahr einer Fehlversorgung spezieller Aminosäuren:
- Vitamin-B3-Mangel (Niacin) führt unter Umständen zu einem Mangel an Tryptophan.
- Bei B6-Mangel (Pyridoxin) kann es zum Verlust von Tryptophan, Methionin oder Glycin kommen.
- Bestimmte Medikamente können einen Tryptophanmangel als Nebenwirkung verursachen.
- Einseitige Ernährung, zum Beispiel mit Mais, kann ebenfalls zu einem Tryptophanmangel führen.
- Übermäßig vorhandene Aminosäuren verdrängen andere Aminosäuren an der Blut-Hirn-Schranke.
Die Aufzählungen sind trotz ihres Umfangs beispielhaft. Im individuellen Einzelfall sind daher sämtliche Lebensumstände ‑ insbesondere Erkrankungen ‑ bei der Einschätzung über etwaige Aminosäurenfehlversorgungen zu berücksichtigen.
4.4 Mikronährstoffmangel und Affektstörungen
▲
Mikronährstoffe ‑ im Wesentlichen Vitamine, Mineralstoffe und Spurenelemente ‑ sind im Vergleich mit Aminosäuren etwas vielfältiger, jedoch haben auch sie nur eine geringe allgemeine zellphysiologische Relevanz (→ Kapitel 3). Das bedeutet: Mikronährstoffmangel ist im Zusammenhang mit einer psychiatrisch-neurologischen Erkrankung in der Regel ein Nebenaspekt.
Zweifelsfrei gibt es jedoch eine spezifische Relevanz des Mikronährstoffmangels bei Erkrankungen des Zentralnervensystems bzw. Affektstörungen. Bestimmte (spezifische) Personenkreise sind Gefahren durch Mikronährstoffmängel stärker ausgesetzt als andere.
Auch in diesem Abschnitt geht es grundsätzlich um den Zustand der Unterversorgung mit Mikronährstoffen. Situationen, bei denen es zu einer Überversorgung kommt, sind relativ selten und kommen auf natürliche Weise fast kaum zustande. Eine Überversorgung kann beispielsweise auf der Verwendung von Nahrungsergänzungsmitteln oder einer einseitigen Ernährung beruhen. Fragen zur therapeutischen Anwendung höherer Dosen von Mikronährstoffen, die über die empohlenen Tagesbedarfe hinausgehen, werden im nächsten Kapitel erörtert (→ Orthomolekulare Medizin im Kapitel 5).
Tabelle 7 stellt hier relevante Mikronährstoffaktivitäten nach allgemeinen Funktionen und affektrelevanten Prozessen dar und informiert über Tagesbedarfe. Die Tabelle fasst Inhalte der Abschnitte 2.3.1 bis 2.3.5 des Kapitels 2 zusammen. Danach sind sämtliche Mikronährstoffe für das Zentralnervensystem unverzichtbar und haben bei affektiv erkrankten Personen mit Mangelversorgungsgefahr potentiell eine Bedeutung.
Aus systematischen Gründen werden die Aufgaben der beiden n-3-Fettsäuren DHA, EPA und der Fettbegleitstoffe Phosphatidylcholin und Phosphatidylinositol schon in diesem Abschnitt (statt im nächsten Abschnitt 4.5 über Fette und Fettbegleitstoffe) erörtert, da sie traditionell als Mikronährstoffe betrachtet werden.
TABELLE 7: ÜBERSICHT ÜBER MIKRONÄHRSTOFFFUNKTIONEN IM ZENTRALNERVENSYSTEM (ZNS)
Mikronährstoff(e) und Tagesbedarf lt. DGE für Erwachsene |
Allgemeinrelevante ZNS-Prozesse |
Prozesse mit besonderer Bedeutung für Affekte und Affekterkrankungen |
|---|---|---|
| Retinol (A) 0,8 - 1,1 mg/Tag |
- Proteinbiosynthese: Transkription - Myelin-Synthese (Reizweiterleitung) |
- Keine direkten Aktivitäten bekannt |
| Thiamin (B1) 1,0 - 1,4 mg/Tag |
- Nervenzellmembranen-Bestandteil - Cholin-Schutz |
- Melatonin-Synthese - Acethylcholin-Synthese - Adrenalin-Synthese - GABA-Synthese - Serotonin-Synthese |
| Riboflavin (B2) 1,2 - 1,5 mg/Tag |
- Aufbau der Myelinschicht | - Keine direkten Aktivitäten bekannt |
| Niacin (B3) 13 - 17 mg/Tag |
- Proteinbiosynthese: Transkription - Synthese Neurotransmitter |
- Melatonin-Synthese (indirekt) - Serotonin-Synthese (indirekt) |
| Pantothensäure (B5) 6 mg/Tag |
- Taurin-Synthese | - Acetylcholin-Synthese |
| Pyridoxin (B6) 1,2 - 1,6 mg/Tag |
- Energie-Stoffwechsel - Taurin-Synthese |
- Melatonin-Synthese - Dopamin-Synthese - Noradrenalin-Synthese - Serotonin-Synthese |
| Biotin (B7) 30 - 60 µg/Tag |
- Proteinbiosynthese: Transkription - Energie-Stoffwechsel |
- Keine direkten Aktivitäten bekannt |
| Folsäure (B9) 300 µg/Tag |
- Proteinbiosynthese: Transkription |
- Melatonin-Synthese - Dopamin-Synthese - GABA-Synthese - Noradrenalin-Synthese - Serotonin-Synthese |
| Cobalamin (B12) 3,0 µg/Tag |
- Proteinbiosynthese: Transkription - Aufbau Hirnzellmembranen - Homocystein-Abbau |
- Melatonin-Synthese - Acetylcholin-Synthese - Noradrenalin-Synthese - Serotonin-Synthese |
| Ascorbinsäure (C) 100 mg/Tag |
- Kollagen-Synthese - Antioxidans-Funktion |
- Melatonin-Synthese - Noradrenalin-Synthese - Serotonin-Synthese |
| Vitamin-D-Gruppe 20 µg/Tag |
- Proteinbiosynthese: Transkription (?) - Reizweiterleitung - Reizleitgeschwindigkeit - Hirnzellwachstum - Neurotransmitter-Synthese (?) - Antioxidans-Funktion |
- Synthese affektrelevanter Neurotransmitter (?) |
| Vitamin-E-Gruppe 12 - 15 mg/Tag |
- Proteinbiosynthese (?) - Antioxidans-Funktion |
- Keine direkten Aktivitäten bekannt |
| Vitamin-K-Gruppe 60 - 80 µg/Tag |
- Keine direkten Aktivitäten bekannt | - Keine direkten Aktivitäten bekannt |
| (Phosphatidyl-)Cholin 425 - 550 mg/Tag* |
- Zellmembranenbestandteil - Homocystein-Abbau - Schutz des Membrancholesterins |
- Acetylcholin-Synthese |
| (Phosphatidyl-)Inositol 1 - 2 gr/Tag** |
- Zellmembranenbestandteil - Reizübertragung (Second messenger) |
- Acetylcholin-Synthese - Serotonin-Synthese |
| DHA + EPA 0,2 gr//Tag*** |
- DHA: Hirnzellmembranenbestandteil - DHA: Myelin-Synthese (Reizweiterleitung) - EPA: Nervenreizübertragung |
- Keine direkten Aktivitäten bekannt |
| Calcium 1,0 - 1,2 gr/Tag |
- Nervenreizweiterleitung - Neuropeptid-Synthese - Neurotrophin-Synthese |
- Melatonin-Synthese - Acetylcholin-Synthese - Noradrenalin-Synthese - Serotonin-Synthese |
| Kalium 550 mg/Tag |
- Nervenreizweiterleitung - Nervenreizübertragung |
- Keine direkten Aktivitäten bekannt |
| Natrium 550 mg/Tag |
- Nervenreizweiterleitung - Nervenreizübertragung |
- Keine direkten Aktivitäten bekannt |
| Magnesium 350 - 400 mg/Tag |
- Proteinbiosynthese - Nukleinsäuren-Synthese - Nervenreizweiterleitung - Nervenreizübertragung |
- Keine direkten Aktivitäten bekannt |
| Phosphor 700 - 1.200 mg/Tag |
- Proteinbiosynthese - Hirnzellmembranen |
- Keine direkten Aktivitäten bekannt |
| Chrom 30 - 300 µg/Tag |
- Proteinbiosynthese: Transkription (?) - Blutzuckerregulation |
- Keine bekannt bzw. unklar |
| Eisen 10 - 15 mg/Tag |
- Sauerstoffversorgung |
- Melatonin-Synthese - Acetylcholin-Stoffwechsel - Dopamin-Stoffwechsel - GABA-Stoffwechsel - Serotonin-Stoffwechsel |
| Jod 180 - 200 µg/Tag |
- Proteinbiosynthese - T3- und T4-Synthese |
- T3- und T4-Synthese |
| Kobalt |
→ Cobalamin (B12) in dieser Tabelle | → Cobalamin (B12) in dieser Tabelle |
| Kupfer 1,0 - 1,5 mg/Tag |
- Energieversorgung - Kollagen-Synthese - Myelin-Synthese (Reizweiterleitung) |
- Adrenalin-Synthese - Dopamin-Synthese - Noradrenalin-Synthese |
| Mangan 2,0 - 5,0 mg/Tag |
- Nukleinsäuren-Synthese - Funktionen in Gliazellen |
- Dopamin-Synthese |
| Molybdän 50 - 100 µg/Tag |
- Keine direkten Aktivitäten bekannt | - Keine direkten Aktivitäten bekannt |
| Rubidium keine Empfehlung |
- Nervenreizübertragung (?) | - Unklar |
| Selen 30 - 70 µg/Tag |
- Antioxidans-Funktion - Glutaminsäure-Abbau |
- Adrenalin-Stoffwechsel - Noradrenalin-Stoffwechsel |
| Zink 10 mg/Tag |
- Nukleinsäuren-Synthese - Proteinbiosynthese - Glycin-Stoffwechsel - Myelin-Synthese (Reizweiterleitung) |
- Keine direkten Aktivitäten bekannt |
Tabelle 7: Mit Ausnahme der Vitamin-K-Gruppe und dem Spurenelement Molybdän (siehe dazu auch Tabelle 8) sind für alle Mikronährstoffe allgemeine Funktionen im Gehirn belegt. Die meisten erfüllen darüber hinaus noch direkte Aufgaben bei der Affektverarbeitung.
*) Für Phosphatidylcholin gibt es keine Empfehlungen der DGE, die hier genannten Mengen stammen von der US-amerikanischen Food and Nutrition Board (FNB) und betreffen nicht den Tagesbedarf, sondern die täglich empfohlene Ergänzungsmenge.
**) Für Phosphatidylinositol gibt es generell keine offiziellen Empfehlungen, in verschiedenen Publikationen werden täglich notwendige Ergänzungsmengen von
1.000 bis 2.000 mg genannt.
***) Für DHA und EPA gibt es verschiedene Tagesbedarfsangaben, die angegebene Menge empfiehlt die FDE (FoodDrugEurope).
Ursachen einer Mikronährstoffunterversorgung
Eine Unterversorgung mit einem einzelnen Vitamin wird als Hypovitaminose, eine Unterversorgung mit sämtlichen Vitaminen als generelle Hypovitaminose bezeichnet. Die Avitaminose ist das vollständige Fehlen eines bestimmten Vitamins. Für Mineralstoffe und Spurenelemente gibt es keine vergleichbaren Bezeichnungen.
Die individuelle Mikronährstoffversorgung unterliegt...
- langfristigen Ernährungsgewohnheiten,
- regionalen Gegebenheiten (insbesondere der Bodenqualität),
- den Einflüssen vor allem chronischer bzw. schwerer Erkrankungen und
- bestimmten sonstigen Lebensumständen.
Zur Problematik empfohlener Tagesmengen
Abgesehen davon, dass es sich bei Tagesmengenangaben immer um Durchschnittswerte handelt, kann niemand für sich in Anspruch nehmen, die exakten Werte zu kennen. Es gibt je nach Quelle verschiedene Empfehlungen. Die Bekanntesten sind die der Deutschen Gesellschaft für Ernährung e. V. (DGE) oder der amerikanischen Food and Drug Administration (FDA). Die daraus entstehenden Unsicherheiten sind bei den nachfolgenden Diskussionen zu beachten.
In den nun folgenden Abschnitten 4.4.1 ff. werden verschiedene Mangelursachen beschrieben.
4.4.1 Mikronährstofffehlversorgung und Ernährung
Bei den langfristigen Ernährungsgewohnheiten sind...
- Mangelernährung,
- längeres (Heil-)Fasten bzw. Hungerkuren oder Diäten,
- langfristige Fehlernährung,
- Ernährung mit Mischkost,
- vegetarische Ernährungsweise oder
- vegane Ernährungsweise
zu unterscheiden.
Mangelernährung führt kurz-, mittel- oder langfristig zu einer generellen Mikronährstofffehlversorgung, da der Körper insgesamt zu wenig oder keine Nahrung erhält. In westlichen Ländern kommen solche Situationen häufig im Zusammenhang mit Fastenkuren oder Diäten vor. Eine generelle Mangelernährung ist vor allem ein Problem der Entwicklungsländer.
Bei einer besonders fettarmen Ernährung, wie sie häufig während einer Diät praktiziert wird, ist die Versorgung mit den fettlöslichen Vitaminen A, D, E und K, den n-3- und n-6-Fettsäuren und den Phospholipiden (zum Beispiel Phosphatidylcholin oder -insositol) gefährdet.
Eine längerfristige Fehlernährung in westlichen Ländern betrifft vor allem den übermäßigen Genuss von zucker-, salz- und fettreichen Nahrungsmitteln sowie industriell hergestellen bzw. veränderten oder minderwertigen Produkten und stark einseitiger Ernährung, beispielsweise durch einen hohen Anteil von poliertem Reis, Weißmehl und Mais. Es kommt zu Mangelerscheinungen aufgrund einer zu geringen Zufuhr oder eines höheren Verbrauchs von Mikronährstoffen.
Gerade ein hoher Konsum von Mais auf Kosten vollwertigen Getreides oder Reis kann zu einem Niacin-Mangel (B3) führen. Dasselbe geschieht auch bei einer sehr proteinarmen Ernährung (→ Abschnitt 4.3).
Übermäßiger Verzehr von rohem Fisch führt unter Umständen zu einem Vitamin-B1-Mangel (Thiamin).
Phytinsäurehaltige Nahrungsmittel, beispielsweise Hülsenfrüchte, Ölsaaten oder Getreide, führen bei einseitigem Konsum zu Mängeln in der Versorgung mit Mineralstoffen und Spurenelementen, beispielsweise Magnesium, Calcium, Eisen oder Zink.
Bei Säuglingen kann es bei der Verwendung von Muttermilchersatzprodukten auf Kuhmilchbasis als Hauptnahrungsquelle zu einer Mangelversorgung kommen.
Mikronährstoffmangelerscheinungen bei verschiedenen Ernährungsmethoden
Bei einer ausgewogenen Ernährung mit Mischkost ist in den meisten Fällen von einer ausreichenden Mikronährstoffversorgung bei Gesunden auszugehen. Anders sieht es bei besonderen Ernährungsweisen aus, hier sind vor allem vegetarische und vegane Ernährungsformen zu nennen, oder bei bestimmten Erkrankungen. Hier kann es zur Mangelversorgung und Problemen im Bereich Psyche/Nervensystem kommen.
Folgende Mangelversorgungen werden diskutiert:
- Vitamin B2 - Riboflavin
Riboflavin ist sowohl in tierischen als auch pflanzlichen Lebensmitteln enthalten, jedoch überwiegen hier tierische, insbesondere Fleisch. Das führt häufig zu der Vermutung, die vegetarische oder vegane Lebensweise würde einen Riboflavinmangel begünstigen.
Milch und Milchprodukte, Getreideprodukte aus Vollkorn (Weizen und Roggen), verschiedene Gemüsearten (zum Beispiel Kartoffeln, Brokkoli, Paprika) und Erbsen enthalten ebenfalls genügend Riboflavin zur Deckung des Tagesbedarfs. Eine Mangelversorgung bei ausgewogener Mischkost oder vegetarischer Kost mit Eiern und Milchprodukten (ovo-lacto-vegetarisch) ist daher fast ausgeschlossen. Veganer sollten besonders auf abwechslungsreiche Nahrungsmittel achten, dann wird die Versorgung mit Riboflavin auch hier gewährleistet sein.
Potentielle B2-Mangelerscheinungen sind Antriebslosigkeit, Appetitlosigkeit, Depression, Krampfanfälle und Müdigkeit.
- Vitamin B3 - Niacin
Bei einer generell geringen Eiweißaufnahme und/oder einem verminderten Tryptophan-Anteil im Nahrungsprotein besteht die Gefahr, dass das vorhandene Tryptophan für die Niacin-Synthese nicht ausreicht. Gefährdet sind vor allem Veganer (→ Abschnitt 4.3).
- Vitamin B5 - Pantothensäure
Tierische Nahrungsmittel enthalten Pantothensäure, vor allem Innereien, Geflügelfleisch und Eigelb, ebenfalls Milch oder Joghurt. Ansonsten sind Vollkornprodukte, Hülsenfrüchte, Kartoffeln und Avocado eine gute Quelle. Mangelerscheinungen haben auch Vegetarier und Veganer in der Regel nicht zu erwarten.
B5-Mangelzustände können potentiell zu Krampfanfällen, Müdigkeit und Nervenstörungen an den Extremitäten führen.
- Vitamin B6 - Pyridoxin
Ein Pyridoxin-Mangel wird bei Vegetarieren bzw. Veganern diskutiert. Pyridoxin ist jedoch in so vielen Lebensmitteln enthalten, dass in der Regel keine Mangelversorgung zu befürchten ist.
Potentielle B6-Mangelerscheinungen sind Appetitlosigkeit, Bewegungsstörungen, Depression, Erschöpfung, Konzentrationsstörungen, Krampfanfälle, Lähmungen, Müdigkeit, Psychosen, Reizbarkeit, Schlafstörungen, Verwirrtheit und Zittern.
- Vitamin B7 - Biotin
Die Aufnahme von Biotin ist bei Menschen gestört, die viele rohe Eier essen, was eher selten vorkommt. Das im Eigelb vorkommende Avidin blockiert die Vitaminresorption.
Zu den B7-Mangelerscheinungen zählen Angstzustände, Appetitlosigkeit, Depression, Müdigkeit und Nervenstörungen an den Extremitäten.
- Vitamin B9 - Folsäure
Der Folsäuregehalt vieler Lebensmittel ist häufig gering, so dass die Gefahr einer Mangelversorgung groß ist (→ Kapitel 2). Ausnahmen sind Nüsse und Hülsenfrüchte, die sehr reichhaltig an Folsäure sind.
Besondere Aufmerksamkeit sollte daher generell dem B9-Gehalt der Nahrung gewidmet werden, da weder Fisch, Rindfleisch, Milchprodukte ‑ Ausnahmen sind bestimmte Weichkäsearten ‑, Eier oder Obst ergiebige Folsäurequellen sind. Vegetariern stehen daher mit Milchprodukten und Vollei leider keine Alternativen zur Verfügung. Alle drei Ernährungsformen bieten keinen Schutz vor einer Folsäureunterversorgung.
Vermutete B9-Mangelerscheinungen sind Antriebslosigkeit, Appetitlosigkeit, Demenz, Depression, Konzentrationsstörungen, Müdigkeit und Reizbarkeit.
- Vitamin B12 - Cobalamin
Cobalamin ist die Substanz, bei denen Vegetarier und vor allem Veganer besondere Obacht haben müssen, auch wenn in den einschlägigen Internetforen und Büchern das Thema meist verharmlost wird. B12 ist in pflanzlicher Nahrung so gut wie nicht enthalten und ein B12-Mangel kann sich u. a. im Nervensystem mittel- bis langfristig verheerend auswirken.
Ovo-lacto-Vegetarier haben einen kleinen Vorteil, denn Milchprodukte und Eier haben einen geringen Gehalt an B12, der jedoch nicht für eine Versorgung ausreicht.
Aber auch bei Mischköstlern ist die B12-Versorgung gefährdet, da es überwiegend in Innereien enthalten ist. Muskelfleisch liefert, entgegen anderslautenden Berichten, leider viel zu wenig dieser wichtigen Substanz. Da der Verzehr von Innereien jedoch immer mehr zurückgeht, besteht auch bei Mischköstlern die Gefahr einer Minderversorgung.
Potentielle B12-Mangelerscheinungen sind Antriebslosigkeit, Demenz, Depression, Konzentrationsstörungen, Müdigkeit, funikuläre Myelose, Neuropathien, Schwindel und Vergesslichkeit.
- Vitamin-D-Gruppe
Bei regelmäßigen Aufenthalten im Freien und ausreichender Sonneneinstahlung kann der Körper gesunder Personen in der Regel genügend Vitamin D selber herstellen. Im Winter sinken die dafür nötigen UV‑B‑Anteile des Lichts in nördlichen Breiten jedoch so stark, dass die Produktion zum Erliegen kommt. Ebenfalls sind Menschen betroffen, die sich wenig dem Tageslicht aussetzen oder deren Haut Probleme mit der D-Synthese hat. Dieses Thema wird in Abschnitt über die Saisonal abhängige Depression (SAD) bzw. Lichtmangeldepression noch ausführlicher behandelt (→ Abschnitt 4.13.1).
Calciol (Vitamin D3) ist in pflanzlichen Lebensmitteln nicht enthalten. Mischköstler sind daher ganz klar im Vorteil, ovo-lactor-Vegetarier können durch den Verzehr von Eiern und Käseprodukten genügend Vitamin D aufnehmen. Veganer sind hier, wie beim Cobalamin (B12), im Nachteil.
Wie eingangs schon erwähnt besteht bei Menschen, die sich besonders fettarm ernähren, die Gefahr des Vitamin-D-Mangels, da D-Vitamine fettlöslich sind. Das gilt auch für die anderen fettlöslichen Vitamine A, E und die K-Gruppe.
Mögliche Calciol-Mangelerscheinungen sind Denkstörungen, Depression, Krampfanfälle, Muskelkrämpfe, niedriger Muskeltonus, Psychosen und Schlafstörungen.
- Eicosapentaensäure, Docosahexaensäure
Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) kommen ausschließlich in Fischen vor. Einige Pflanzenöle enthalten alpha‑Linolensäure, die ebenfalls eine n‑3‑Fettsäure ist und im Körper zu EPA bzw. DHA umgewandelt werden muss.
Bei Mischköstlern ist der regelmäßige Verzehr von Fischprodukten eine Möglichkeit, Mangelzustände zu verhindern. Da bei vielen der Fischkonsum jedoch eingeschränkt ist, besteht die Gefahr der Unterversorgung auch bei Mischkost.
Vegetarierer und Veganer essen keine Fischprodukte und müssen ihren Bedarf ausschließlich über Öle decken, was aber nicht ausreicht. Da vegetarische Ernährung darüber hinaus die Zufuhr von n‑6‑Fettsäuren begünstigt, haben Vegetarier und vor allem Veganer oft ein ungünstiges Verhältnis von n‑6 : n‑3. Das sollte maximal bei 5 : 1 liegen, bei ihnen ist es aber signifikant erhöht.
Bei einer EPA- bzw. DHA-Mangelversorgung kann es zu Antriebshemmung, Aufmerksamkeitsdefiziten, Affektstörungen mit Stimmungsschwankungen, Demenz, Denkstörungen, Depression, Erinnerungsstörungen, Gereiztheit, Konzentrationsstörungen, Psychosen und Schlafstörungen kommen.
- Calcium
Calcium wird am meisten über Milch, Milchprodukte und Mineralwasser aufgenommen, so dass Mischkostnahrung oder ovo-lacto-vegetarische Ernährung eigentlich keine Mangelversorgung zur Folge haben dürfte. Dennoch gibt es in Deutschland generelle Defizite in der Calciumversorgung.
Bei Mischköstlern liegt das oft am hohen Fleischkonsum, denn tierische Eiweiße erhöhen die Calciumausscheidung.
Ovo-lacto-Vegetarier stecken hier in einem Dilemma, denn ein zu geringer Konsum von Milchprodukten hat eine zu niedrige Zufuhr von Calcium zu Folge, ein zu hoher Konsum führt zu einem zu hohen Anteil tierischen Proteins.
Sowohl Vegetarier als auch Veganer haben noch ein generelles Problem mit pflanzlichen Nahrungsmitteln, denn diese bieten nicht nur weniger Calcium, viele Pflanzen enthalten Substanzen, welche die Calciumaufnahme zusätzlich erschweren.
Der Vorteil der Veganer ist demgegenüber eine geringere Calciumausscheidung wegen deren Verzicht auf Proteine tierischen Ursprungs.
Typische Calcium-Mangelerscheinungen sind Gereiztheit, Sensibilitätsstörungen, Störungen der Motorik oder Tetanie.
- Eisen
Beim Spurenelement Eisen sind aufgrund unterschiedlicher Bioverfügbarkeiten und seiner Verwendung im Körper mehrere Besonderheiten zu beachten.
Eisen liegt in der Nahrung in zwei Formen vor und wird generell schlecht vom Körper aufgenommen. Zweiwertiges Eisen kann im Gegensatz zum dreiwertigen Eisen etwas besser resorbiert werden, ist aber nur in Fleisch- oder Fischprodukten enthalten. Pflanzliche Nahrungsmittel enthalten ausschließlich das schlechter verfügbare dreiwertige Eisen. Erschwerend kommt hinzu, dass die Aufnahme von dreiwertigem Eisen durch zahlreiche Nahrungsmittel weiter gehemmt oder sogar unterbunden werden kann.
Auch Mischköstler sind daher nicht vor Eisenmangel gefeit. Bei Vegetarieren und Veganern besteht allerdings eine höhere Eisenmangelgefahr.
Es wird zwischen manifestem Eisenmangel und latentem Eisenmangel unterschieden. Zu einem manifesten Eisenmangel kommt es aus Ernährungssicht nur durch eine generelle Unterernährung. Hier ist nicht nur die tägliche Eisenversorgung unzureichend, auch die Eisenspeicher im Körper sind entleert. 20% des Eisens im Körper ist das als Ferritin bezeichnete Speicher- oder Reserveeisen und befindet sich in Knochenmark, Leber und Milz.
In westlichen Ländern kommt es eher zum latenten Eisenmangel mit zu geringen Eisenspeichern. Die tägliche Zufuhr reicht zusammen mit dem restlichen Speichereisen Ferritin für die Versorgung des Blutes mit Eisen aus und es kommt noch nicht zu einer Anämie. Es besteht gleichwohl kurz-, mittel- und langfristig die Gefahr, dass der latente Eisenmangel in einen manifesten übergeht.
Probleme eines Eisenmangels können Antriebsschwäche, Appetitlosigkeit, Depression, Gereiztheit, Konzentrationsstörungen, Kopfschmerzen, Müdigkeit, Nervosität oder Schwindel sein.
Darüber hinaus dann es zu einem Eisenmangel-Syndrom ohne Anämie kommen. Hierbei liegt kein messbarer oder ein nur geringer Eisenmangel vor, Blutbildung und Sauerstoffversorgung sind jedoch nicht eingeschränkt. Dennoch verschwinden die Symptome einer Depression nach Einnahme von Eisenpräparaten oder Eiseninfusionen (→ Abschnitt 2.3.5).
- Jod
Eine ausreichende Jodversorgung ist nur durch den Konsum tierischer Lebensmittel möglich. Vegetarier und insbesondere Veganer sind daher jodmangelgefährdet.
Speziell bei Jod spielt die Bodenqualität ein große Rolle, dieser regionale Aspekt wird im nächsten Abschnitt thematisiert.
Allerdings ist einem Jodmangel durch die Verwendung jodierten Speisesalzes einfach vorzubeugen.
Zu den Jodmangelerscheinungen gehören Antriebsschwäche, Depression, Gehirnreifungsstörungen, Intelligenzminderung, Konzentrationsstörungen, Leistungsabfall und Müdigkeit.
- Selen
Selen kommt sowohl in pflanzlichen als auch tierischen Lebensmitteln in der Regel ausreichend vor, so dass allein aus der Sicht der Ernährungsgewohnheiten bei abwechslungsreicher Kost kein Selenmangel zu befürchten ist.
Besonders bei Selen spielt - wie beim Jod - die Bodenqualität ein große Rolle, dieser regionale Aspekt ist Thema des nächsten Abschnitts.
Häufige Begleiterscheinungen eines Selenmangels sind Antriebsschwäche, Depression und Müdigkeit.
- Zink
Bei Zink sind Mischköstler klar im Vorteil, da Lebensmittel tierischen Ursprungs zinkreichhaltiger sind. Bei einer bewussten vegetarischen oder veganen Ernährung sollte es aber nicht zum Mangel kommen, da es genügend pflanzliche Alternativen mit hohem Zinkgehalt gibt, beispielsweise Erdnüsse, Haselnüsse, Linsen, Haferflocken, Hirse, Mais oder Roggenmehl.
Aus Zinkmangel resulieren häufig Antriebsschwäche, Depression, Konzentrationsstörungen und Müdigkeit.
4.4.2 Mikronährstoffversorgung und regionale Bodenqualität
Neben den Ernährungsgewohnheiten beeinflussen die regionale Qualität der Land- und Viehwirtschaft oder andere regionale Besonderheiten die Versorgung mit Mineralstoffen und Spurenelementen, wobei die Bodenqualität hier wesentlich ist. Daneben spielen noch der Überzüchungsgrad des Anbauguts, die Art und Weise der Düngung, der Reifegrad nach der Ernte, die Lagerqualität und die Haltungsbedingungen für das Nutzvieh eine Rolle.
Die Bodenqualität wird von der Schadstoffbelastung, dem Nährwertgehalt des Bodens an Mineralstoffen/Spurenelementen und dem pH-Wert beeinflusst. Landwirtschaftliche Intensivnutzung und Erosion können regional zu einem niedrigen Nährwertgehalt des Bodens führen.
Die Diskussion, ob es sich dabei um eine teilweise bewusste Übertreibung oder ein tatsächliches Problem handelt, wird kontrovers geführt. Man findet Quellen, die sowohl die eine als auch die andere Ansicht stützen.
Zum Beispiel wird die Eifel allgemein als Selenmangelgebiet betrachtet. Ein regionaler Anbieter von Agrarprodukten behauptet, dass der Selengehalt des Weizens in Deutschland von 1968 bis heute (2014) von 100 bis 300 µg auf 5 bis 25 µg pro kg Trockenmasse zurückgegangen ist (Quelle: Raiffeisen Rhein‑Ahr‑Eifel Handelsgesellschaft mbH, www.raiffeisenserivce.de/selen). Auch in einer Dissertation an der Landwirtschaftlichen Fakultät der Universität Bonn wird die Hocheifel als ein von Selenmangel besonders betroffenes Gebiet bezeichnet (Quelle: L. Schloske 2005). Verschiedene Dissertationen und Studien thematisieren regionale Unterschiede des Selengehaltes von Ackerland.
Landwirtschaftliche Betriebe können jedoch einer Mineralienverarmung des Bodens durch die Zufuhr entsprechender Substanzen leicht entgegenwirken. Helmut Heseker von der Universität Paderborn behauptet beispielsweise, dass ein Zeittrend beim Selengehalt von Weizen und Roggen in Deutschland seit 1946 innerhalb von fast 50 Jahren nicht feststellbar ist und der Zink- und Kupfergehalt der Böden sogar gestiegen ist, was an einer solchen Substitution liegen könnte (Quelle: H. Heseker 2001, Deutschland - ein Selenmangelland?, Universität Paderborn).
Ein besonders einleuchtendes Argument: Mineralstoffunterversorgungen des Bodens führen bei Pflanzen und Tieren zu sichtbaren Mangelzuständen und werden schon aus diesem Grunde von den Landwirten mit Supplementierungen ausgeglichen, denn ansonsten wären ihre Betriebe nicht konkurrenzfähig. Verschiedene landwirtschaftliche Organisationen beraten die Betriebe über die Zugabe von Substanzen, beispielsweise Stickstoff, Phosphor, Kalium, Magnesium, Zink, Bor, Molybdän oder Selen.
Die Auseinandersetzungen zu diesem Thema sollen hier nicht weiter vertieft werden. Kenntnisse dieser Diskussion sind hilfreich, da bei einer Anamnese regionale Versorgungsprobleme zumindest in Erwägung gezogen werden sollten.
Folgende Mineralienverarmung der Böden werden diskutiert:
- Eisen (→ Anmerkungen oben)
- Jod
Jodmangel ist die am besten erforschte regionale Mikronährstoffunterversorgung und medizinisch belegt.
Die Jodversorgung der Bevölkerung speziell in Deutschland wird jedoch kontrovers diskutiert, es gibt Befürworter und Kritiker eines „Jodmangelgebietes Deutschland“. Das liegt auch daran, dass eine zu hohe Jodzufuhr zu gesundheitlichen Problemen führen kann, und eine Beimengung in das Trinkwasser daher teilweise kritisch gesehen wird.
Die WHO hatte in Deutschland allerdings in den 1990er Jahren eine zu niedrige durchschnittliche Jodaufnahme festgestellt.
Der Arbeitskreis Jodmangel der Deutschen Gesellschaft für Endokrinologie und Deutschen Gesellschaft für Ernährung gibt dazu eine Broschüre heraus, die regelmäßig aktualisiert wird: www.jodmangel.de/Broschuere.
Regionaler Jodmangel liegt aber nicht an einer Fehlbewirtschaftung des Bodens, sondern hat geologische Ursachen durch Erosion. In Europa sind insbesondere die Hochgebirgsregionen betroffen.
Primär kann Jodmangel zu Fehlfunktionen der Schilddrüse mit weitreichenden Folgen für den ganzen Organismus führen. Insbesondere können daraus Affektstörungen resultieren. Vermutete oder potentielle Jodmangelerscheinungen wurden oben schon beschrieben.
- Magnesium
Vor allem eine Studie der Bertelsmann Stiftung aus dem Jahre 1998 machte auf die relativ schlechte Versorgung der Bevölkerung mit Magnesium aufmerksam, wofür auch magnesiumarme Böden verantwortlich sein könnten. Die Düngung mit Magnesium wird daher vielerorts empfohlen und auch durchgeführt, so dass der Mangel auch auf andere Defizite zurückgeführt werden könnte.
Typische Magnesiummangelerscheinungen sind Antriebsschwäche, Denkstörungen, Depression, Gereiztheit, Konzentrationsstörungen, Kopfschmerzen, Müdigkeit, Schlafstörungen, Muskelkrämpfe oder Sensibilitätsstörungen an den Extremitäten.
- Mangan
Auch die Düngung des Bodens mit Mangan wird in bestimmten Regionen empfohlen. Funktionen des Mangans im Nervensystem sind bekannt (→ Kapitel 2), jedoch gibt es keine Untersuchungen bezüglich der Symptome bei Unterversorgung. In der Literatur werden Appetitlosigkeit, Psychosen/Schizophrenie und Krampfanfälle/Epilepsie diskutiert.
- Selen (→ Anmerkungen oben)
- Zink (→ Anmerkungen oben)
4.4.3 Mikronährstoffversorgung bei Erkrankungen und anderen Ausnahmesituationen
Zunächst soll auf erkrankungsbedingte Situationen hingewiesen werden, die häufig mit einer generellen Mikronährstoffunterversorgung aufgrund von Fehlernährung und/oder Veränderungen im Stoffwechsel einhergehen. Die Primärursachen sind die gleichen, die auch zu einem generellen Aminosäurenmangel führen können (→ Abschnitt 4.3.2):
- schwere Akuterkrankungen,
- Karzinome, Tumore und während einer Chemotherapie bzw. Strahlentherapie,
- Intelligenzminderungen bzw. geistige Behinderung,
- Immunschwäche (insbesondere HIV/Aids),
- psychiatrische Erkrankungen, insbesondere Affektstörungen, Bulimie/Magersucht und Schizophrenie,
- Suchterkrankungen, insbesondere Alkoholismus,
- Erkrankungen des Verdauungssystems, insbesondere Darmerkrankungen, und
- nach Operationen.
Fälle, bei denen negative Auswirkungen auf bestimmte Mikronährstoffe besonders häufig beobachtet wurden, sind in Tabelle 8 aufgelistet. Auch diese Übersicht ist wegen der Fülle von Erkrankungen und Wechselwirkungen nicht vollständig. Es geht vor allem um die Sensiblisierung, chronische Krankheiten hinsichtlich möglicher Auswirkungen auf die Mikronährstoffversorgung ernstzunehmen.
TABELLE 8: ERKRANKUNGEN UND MIKRONÄHRSTOFFMANGEL
Mikronährstoff(e) |
Erkrankungen und Behandlungen, die sich negativ auf die Mikronährstoffversorgung auswirken |
Mangelsymptome in den Bereichen Psyche und Nervensystem |
|---|---|---|
| Retinol (A) | Verdauungssystem: Darmerkrankungen, insbesondere Entzündungen des Dünndarms, Fettresorptionsstörungen, Malabsorption Inneres: Diabetes*, Schildrüsenüberfunktion, Leber-Galle-Erkrankungen Sonstige: Alkoholismus Medikamente: Cholesterinsenker, Hypnotika, Laxantien |
Appetitlosigkeit, Konzentrationsstörungen, Kopfschmerzen, Müdigkeit |
| Thiamin (B1) | Verdauungssystem: Darmerkrankungen, insbesondere Morbus Crohn Inneres: Diabetes* Sonstige: Alkoholismus, Fieber Therapie: Alkoholentzug, Hämodialyse |
Angststörungen, Appetitlosigkeit, Beriberi, Depression, Gereiztheit, Gedächtnisstörungen, Konzentrationsstörungen, Kopfschmerzen, Müdigkeit, Muskelschwäche, Neuropathien, Verwirrung |
| Riboflavin (B2) |
Sonstige: Alkoholismus Medikamente: Kontrazeptiva, Neuroleptika |
→ Anmerkungen oben |
| Niacin (B3) | Verdauungssystem: Darmerkrankungen, Störungen der Darmflora, Malabsorption Sonstige: Alkoholismus Medikamente: Beta-Rezptorenblocker |
Appetitlosigkeit, Demenz, Depression, Gereiztheit, Konzentrationsstörungen, Schlafstörungen |
| Pantothensäure (B5) | Verdauungssystem: Darmerkrankungen, insbesondere Darmentzündungen, Störungen der Darmflora Inneres: Diabetes*, chronische Entzündungen Sonstige: Alkoholismus Therapie: Hämodialyse |
→ Anmerkungen oben |
| Pyridoxin (B6) | Verdauungssystem: Darmerkrankungen Sonstige: Alkoholismus Medikamente: Antirheumatika, Antituberkulotika, orale Kontrazeptiva |
→ Anmerkungen oben |
| Biotin (B7) | Verdauungssystem: Darmerkrankungen, Darmschleimhautveränderungen, Störungen der Darmflora Sonstige: Biotinidase-Defekt |
→ Anmerkungen oben |
| Folsäure (B9) | Verdauungssystem: Störungen der Darmflora, Magen- und Darmerkrankungen Inneres: Schilddrüsenüberfunktion, Atemwegserkrankungen Medikamente: Antiepileptika, Antidepressiva |
→ Anmerkungen oben |
| Cobalamin (B12) | Verdauungssystem: Erkrankungen des terminalen Ileums/Dünndarmabschnitts, insbesondere Morbus Crohn, Störungen der Darmflora, Magenerkrankungen, Intrinsic-Faktor-Defekte Inneres: Pankreaserkrankungen Medikamente: Antidiabetika (Metformin), Magensäureblocker (Antazida), Antihistaminika, Überschuss an Vitamin C und/oder Folsäure Therapien: Resektion des terminalen Ileums |
→ Anmerkungen oben |
| Ascorbinsäure (C) | Verdauungssystem: Magenerkrankungen, Darmerkrankungen Sonstige: Alkoholismus, Infektionskrankheiten, Verletzungen Medikamente: Antibiotika |
Depression, Gereiztheit, Müdigkeit |
| Vitamin-D-Gruppe | Verdauungssystem: Darmerkrankungen, Fettresorptionsstörungen, Malabsorption Inneres: Leber-Galle-Erkrankungen Urogenital: Niereninsuffizienz Sonstige: Vitamin-D-Mangel-Erbkrankeit Medikamente: Antiepileptika, Antituberkulotika Therapien: Antihormontherapien bei Krebs |
→ Anmerkungen oben |
| Vitamin-E-Gruppe | Verdauungssystem: Darmerkrankungen, Fettresorptionsstörungen, Malabsorption Inneres: Leber-Galle-Erkrankungen |
Empfindungsstörungen, Gereiztheit, Konzentrationsstörungen, Kopfschmerzen, Motorikstörungen, Müdigkeit, Muskelschwäche |
| Vitamin-K-Gruppe | Verdauungssystem: Magenerkrankungen, Darmerkrankungen, Störungen der Darmflora, Fettresorptionsstörungen, Malabsorption Inneres: Leber-Galle-Erkrankungen Medikamente: Antikoagulanzien (Cumarin) |
Konzentrationsstörungen, Kopfschmerzen, Müdigkeit |
| Phosphatidylcholin | Verdauungssystem: Fettresorptionsstörungen Inneres: Leber-Galle-Erkrankungen Sonstige: Alkoholismus, Folsäuremangel, HIV/Aids |
Demenz, Depression, Hirnentwicklungs- störungen und Neuralrohrdefekte beim Fetus, Stimmungsschwankungen |
| Phosphatidylinositol | Verdauungssystem: Fettresorptionsstörungen Inneres: Diabetes* |
Angststörungen, Gereiztheit, Nervosität |
| DHA + EPA | Verdauungssystem: Malabsorption, Fettresorptionsstörungen Inneres: Leber-Galle-Erkrankungen |
→ Anmerkungen oben |
| Calcium | Verdauungssystem: Zöliakie/Sprue Inneres: Unterfunktion der Nebenschilddrüse, Schilddrüsenfehlfunktionen, Pankreatitis Urogenital: Niereninsuffizienz Psyche/NS: Bulimie Sonstige: Vitamin-D-Mangel, Magnesiummangel |
→ Anmerkungen oben |
| Kalium | Verdauungssystem: Magenerkrankungen, Darmerkrankungen, Durchfallerkrankungen, Erbrechen Inneres: Überfunktion der Nebennierenrinde (Conn-Syndrom) Urogenital: Nierenerkrankungen („Kaliumverlustniere“) Nervensystem: Hypophysen- oder Hypothalamusfehlfunktionen Psyche/NS: Bulimie Sonstige: Hypoglykämie Medikamente: Diuretika, Laxantien, Insulin |
Antriebsschwäche, Appetitlosigkeit, Hyporeflexie, Kopfschmerzen, Lähmungen der glatten Muskulatur, Motorikstörungen, Müdigkeit, Muskelkrämpfe, Muskelparese, Nervosität, Schlafstörungen |
| Natrium | Verdauungssystem: Durchfallerkrankungen, Erbrechen Inneres: Unterfunktion der Nebennierenrinde, Diabetes*, Lungenerkrankungen, Karzinome, Herzinsuffizienz, Leberzirrhose, Unterfunktion der Schilddrüsen/Hypothyreose Urogenital: Nierenerkrankungen Psyche/NS: Hypophysen- oder Hypothalamusfehlfunktionen Sonstige: Verbrennungen, Verletzungen, Infektionskrankheiten, Jodmangel Medikamente: Antidiabetika, Diuretika, Hypnotika, Psychopharmaka, Zytostatika |
Antriebsschwäche, Appetitlosigkeit, Epilepse/Krampfanfälle, Hirmödem, Konzentrationsstörungen, Kopfschmerzen, Müdigkeit, Muskelschwäche, Tremor, Verwirrung |
| Magnesium | Verdauungssystem: Durchfallerkrankungen, Erbrechen, Magen- und Darmerkrankungen Inneres: Diabetes*, Unterfunktion der Nebenschilddrüsen Urogenital: Nierenerkrankungen, Niereninsuffizienz Medikamente: Antibiotika, Antimykotika, Diuretika, Zytostatika, Glukokortikoide/Kortison, orale Kontrazeptiva |
→ Anmerkungen oben |
| Phosphor | Verdauungssystem: Magenerkrankungen, Darmerkrankungen Inneres: Lungenerkrankungen, Überfunktion der Nebenschilddrüsen Urogenital: Nierenerkrankungen Sonstige: Alkoholismus, Hypophosphatämie, Sepsis, Vitamin-D-Mangel, Verbrennungen, Verletzungen Medikamente: Antazida, Diuretika |
Müdigkeit |
| Chrom | Verdauungssystem: Magenerkrankungen, Darmerkrankungen Sonstiges: Infektionskrankheiten Therapien: Künstliche Ernährung |
Aggressivität, Depression, Gereiztheit, Konzentrationsstörungen, Muskelschwäche, Lernschwierigkeiten, Nervosität, Sehstörungen, Sensibilitätsstörungen, Verwirrtheit |
| Eisen | Verdauungssystem: Magenerkrankungen, Darmerkrankungen, Malabsorption Inneres: Entzündungen, Karzinome Sonstige: Blutungen, Infektionskrankheiten, Kupfermangel Medikamente: Analgetika, Antiphlogistika |
→ Anmerkungen oben |
| Jod | Verdauungssystem: Magenerkrankungen, Darmerkrankungen |
→ Anmerkungen oben |
| Kobalt | → Cobalamin (B12) in dieser Tabelle |
→ Cobalamin (B12) in dieser Tabelle |
| Kupfer | Verdauungssystem: Magenerkrankungen, Darmerkrankungen, Zöliakie/Sprue, Malabsorption Inneres: Lebererkrankungen Urogenital: Nierenerkrankungen Sonstige: Erblich bedingter Kupfermangel, Blutverlust, Verbrennungen, Zinküberschuss Medikamente: Steroide |
Depression, Konzentrationsstörungen, Menkes‑Syndrom, Müdigkeit, Rückenmarkschädigungen |
| Mangan | Verdauungssystem: Magenerkrankungen, Darmerkrankungen, Malabsorption Inneres: Diabetes*, Lebererkrankungen, Pankreaserkrankungen Urogenital: Nierenerkrankungen Sonstige: Phenylketonurie, Eisen-, Calcium-, Phosphor- oder Zinküberschuss Medikamente: Psychopharmaka |
→ Anmerkungen oben |
| Molybdän** | Verdauungssystem: Darmerkrankungen |
Gereiztheit, Kopfschmerzen, Müdigkeit, Stimmungsschwankungen** |
| Rubidium | Therapie: Hämodialyse |
Depression |
| Selen | Verdauungssystem: Magenerkrankungen, Darmerkrankungen, Durchfallerkrankungen, Malabsorption, Maldigestion Inneres: Karzinome, Diabetes insipidus Psyche/NS: Bulimie, Magersucht Urogenital: Nierenerkrankungen, Glomerulonephritis, Nephrotisches Syndrom Sonstige: Alkoholismus, Verbrennungen, Blutverlust/Verletzungen Medikamente: Diuretika, Laxantienabusus Therapie: Hämodialyse, Sondenernährung, parenterale Ernährung |
→ Anmerkungen oben |
| Zink | Verdauungssystem: Magenerkrankungen, Darmerkrankungen Inneres: Lebererkrankungen, Karzinome Sonstige: Immunschwächekrankheiten, Infektionskrankheiten, erblich bedingte Zinkresorptionsstörung, erhöhter Eisen- oder Kupferspiegel Medikamente: Antibiotika, Antazida Therapie: Parenterale Ernährung |
→ Anmerkungen oben |
Tabelle 8: In der mittleren Spalte werden chronische oder sehr schwere Erkrankungen und Medikamente bzw. Therapien aufgelistet, die zu einem Mangel des betreffenden Mikronährstoffs führen können, rechts die entsprechenden Symptome in den Bereichen Psyche und Nervensystem. Erkrankungen des Verdauungssystems sind die Hauptursache für Unterversorgung, daneben Erkrankungen der Nieren und der Leber und Alkoholismus. Die Aufzählung ist nicht vollständig. Mangelerscheinungen, die schon bei den Ernährungsgewohnheiten und der regionalen Bodenqualität erörtert wurden, sind hier nicht aufgezählt (→ Anmerkungen oben).
*
Diabetes = Diabetes mellitus.
** Obwohl für Molybdän keine direkten Funktionen im Nervensystem belegt sind, werden dennoch psychiatrische Symptome diskutiert. Ein Grund dafür könnte sein, dass sich allgemeine Funktionen des Molybdäns im gesamten Körper auswirken und damit auch relevant für das Gehirn sein können.
Sonstige Einflüsse auf die Mikronährstoffversorgung
Auch besondere Lebenssituationen führen häufig zu einer Mikronährstoffunterversorgung:
- Verminderte Nahrungsaufnahme bei erhöhtem Bedarf alter bzw. hochbetagter Menschen,
- verminderte Nahrungsaufname in Notsituationen (obdachlose Menschen, Verwahrlosung),
- verminderte Synthese bei Tageslichtmangel (betrifft nur Vitamin D3, → Abschnitt 4.13.1),
- Malabsorption wegen Bandwurmbefalls,
- vermehrter Bedarf bei Schwangerschaft und während der Stillzeit,
- vermehrter Bedarf in der Kindheit bis zum Abschluss der Wachstumsphase,
- vermehrter Bedarf bei Sportlern oder stark körperlich tätigen Menschen,
- vermehrter Bedarf bei Stress,
- vermehrter Bedarf unter erhöhtem Verbrauch bei Tabakkonsum (insbesondere Antioxidantien),
- erhöhter Verlust und verminderte Mikronährstoffaufnahme bei starkem Kaffeekonsum,
- erhöhter Verlust bei starkem Schwitzen, zum Beispiel in der Sauna und
- erhöhter Verlust nach bzw. bei häufiger Blutspende.
4.4.4 Empirische Erkenntnisse über Zusammenhänge zwischen Mikronährstoffen und Affektstörungen
Untersuchungen über Zusammenhänge zwischen Affekterkrankungen und Mikronährstoffen sind zahlreicher als solche über Zusammenhänge mit der Eiweiß- bzw. Aminosäurenversorgung. Bei ihnen stehen Fragen zu Unterversorgungen oder Behandlungspotentialen von Mikronährstoffen im Vordergrund.
Über die beiden B-Vitamine Cobalamin (B12) und Folsäure (B9) gibt es eine Reihe von Studien, denn sie werden stärker mit Affekterkrankungen in Verbindung gebracht als andere Vertreter der Vitamin‑B‑Gruppe.
Eine Untersuchung von 700 behinderten, jedoch nicht dementen Frauen im Alter von 65 Jahren ergab, dass deren Folsäure‑Spiegel im Blutserum auf keine Zusammenhänge mit einer Depression hindeutet, ein niedriger Cobalamin‑Spiegel jedoch sehr wohl. Es wurde zwischen schwerer, leichter und keiner Depression unterschieden. Die Quote derjenigen, die einen signifikant niedrigen B12-Spiegel aufwiesen, betrug bei den mental gesunden Frauen 14,9%, bei den mild depressiven schon 17,0% und bei den schwer depressiven 27,0% (Quelle: Penninx, Guralik, Ferrucci et al., Vitamin B12 deficiency and depression in physically disabled older women: Epidemiologic evidence from the Women's Health and Aging Study, The American Journal of Psychiatry, 5/2000, 157 (5), S. 715 - 721, http://ajp.psychiatryonline.org/doi/...).
Dieses Ergebnis bestätigt auch eine Studie aus den Niederlanden, die 278 Frauen und Männer mit Depression bzw. depressiver Symptomatik höheren Alters bezüglich ihres B9- bzw. B12-Status mit 416 zufällig ausgewählten Personen verglich. Beide Gruppen wählte man aus einem Pool von 3.884 untersuchten Personen aus. Dabei wurde ein starker Zusammenhang zwischen einer Erkrankung und der Unterversorgung mit B12 festgestellt, während er bei B9 nur gering ausgeprägt war. Die Ergebnisbereinigung ergab, dass der B9-Mangel eher mit körperlichen Erkrankungen in einem kausalen Zusammenhang steht, während der B12-Mangel unabhängig von solchen auftrat. Daraus wurde geschlossen, dass eine Depression kausal auch auf einen B12-Mangel zurückgeführt werden kann (Quelle: Tiemeier, van Tuijl, Kiliaan et al. 2002, Vitamin B12, folate, and homocysteine in depression: The Rotterdam Study, The American Journal of Psychiatry, 12/2002, 159 (12), S. 2099 - 2101, http://ajp.psychiatryonline.org/doi/...).
Aufgrund einer bekanntermaßen häufig unzureichenden Versorgung der Bevölkerung mit Vitamin D interessieren sich auch hier Forscher dafür, ob Zusammenhänge mit Affektstörungen nachweisbar sind.
Im Rahmen einer Meta-Studie am New Yorker Columbia University Medical Center wurden drei Veröffentlichungen untersucht (Chan et al. 2012, May et al. 2010 und Milaneschi et al. 2010), die an Personen mit einem durchschnittlichen Alter von mehr als 70 Jahren durchgeführt wurden. Sie kam zu dem Ergebnis, dass bei Individuen mit einem Vitamin‑D‑Defizit ein 2,3‑fach höheres Risiko besteht, an einer Depression zu erkranken und konstatierte einen Bedarf für weitere Untersuchungen. Leider können die Ergebnisse nicht auf die Situation jüngerer Personen unter 50 Jahren übertragen werden und auch die Kausalitätsfrage nicht beantworten (Quelle: J. A. Shaffer, D. Edmondson et al. 2013: Vitamin D Supplementation for Depressive Symptoms: A Systematic Review and Meta-Analysis of Randomized Controlled Trials, Center for Behavioral Cardiovascular Health, Columbia University, Psychosomatic Medicine, April 2014, 76 (3), S. 190 - 196, http://journals.lww.com/..).
Im selben Jahr kamen andere Forscher zu einem ähnlichen Ergebnis, wobei ihre umfangreichere Meta-Studie 14 Untersuchungen unterschiedlichen Studien-Designs mit insgesamt über 31.000 Teilnehmern zugrunde legte und auch jüngere Menschen umfasste. Es wurden geringere Vitamin‑D‑Spiegel bei depressiv erkrankten Patienten gefunden als bei gesunden Personen und ebenfalls ein erhöhtes Quotenverhältnis bzw. eine erhöhte Hazard Ratio bei Depression von niedrigen zu höchsten Vitamin‑D‑Spiegeln festgestellt. Ein niedriger Wert steht demnach mit Depressionserkrankungen in einem signifikanten Zusammenhang. Eine Aussage bezüglich der Kausalität dieser Assoziation ist nach den Schlussfolgerungen der Autoren auf Grundlage weiterer Studien zu klären, bei denen Therapien mit Vitamin D Untersuchungsgegenstände sein müssten (Quelle: Rebecca Anglin, Zainab Samaan et al. 2013, Vitamin D deficiency and depression in adults: Systematic review and meta-analysis, The British Journal of Psychiatry 2013, 202, S. 100 - 107, doi: 10.1192/bjp.bp.111.106666, http://bjp.rcpsych.org/...).
Cholin steht zwar als Ausgangssubstanz sowohl für das Phosphatidylcholin der Membranen von Neuronen und Gliazellen und als auch für den Neurotransmitter Acetylcholin im Fokus der Hirnforschung, jedoch werden hier leider meist motorische Funktionen, das Gedächtnis oder die Konzentrationsfähigkeit untersucht. Dagegen ist Inositol bzw. Phosphatidylinositol häufiger Gegenstand von Untersuchungen über Zusammenhänge mit affektiven Erkrankungen, wobei es sich meist um Therapiestudien handelt. Die Bedeutung von Inositol bei der Synthese von Serotonin oder von Inositol-1,4,5-triphosphat bzw. IP3 als Second messenger spielt hier vermutlich eine Rolle. Daneben hat Phosphatidylinositol wichtige strukturelle Aufgaben in den Membranen und diese könnten ebenfalls dafür verantwortlich sein, dass die Substanz in Studien mit einem geringeren Depressionsrisiko in Verbindung gebracht wird.
Eine kontrollierte Doppelblind-Studie mit 28 Teilnehmern ergab, dass nach einer Behandlung mit 12 Gramm Inositol pro Tag ein Rückgang der depressiven Symptomatik bei denjenigen Patienten erzielt wurde, die den Wirkstoff und nicht das Scheinpräparat bekamen. (Quelle: J. Levine et al. 1995: Double-blind, controlled trial of inositol treatment of depression, American Journal of Psychiatry, 5/1995, 152 (5), S. 792 - 794, http://ajp.psychiatryonline.org/...). Eine kurz danach durchgeführte Anschlussstudie bestätigte die Erkenntnisse aus der ersten Untersuchung. Die Autoren um J. Levine weisen darauf hin, dass der generelle Zusammenhang einer Depression mit einem niedrigen Inositol-Spiegel schon belegt wurde. Dieser Zusammenhang soll sich beispielsweise aus einer Studie des Jahres 1978 ergeben, die bei depressiv erkrankten Personen einen niedrigen Inositol-Spiegel im Liquor ergab (Quelle: Al Barkai et al. 1978: Reduced myo-inositol levels in cerebrospinal fluid from patients with affective disorder, Biological Psychiatry, 2/1978, 13 (1), S. 65 - 72, http://psycnet.apa.org/...).
Eine relativ aktuelle Meta-Analyse von Studien über Zusammenhänge zwischen verschiedenen Affektstörungen und Inositol ergab, dass der Wirkstoff ingesamt einen eher geringen positiven Effekt auf die meisten Symptomatiken hatte mit Ausnahme der Prämensturellen Depression PMD. Die Übersichtsstudie umfasste auch Untersuchungen zur Bipolaren Affektstörung und Major Depression (Quelle: T. Mukai, T. Kishi et al. 2014, A meta-analysis of inositol for depression and anxiety disorders, Human Psychopharmacology Clinical and Experimental 01/2014, 29 (1), S. 55 - 63, http://www.ncbi.nlm.nih.gov/...).
Die mehrfach ungesättigten Fettsäuren n‑3 und n‑6 sind häufig Gegenstand von Untersuchungen über einen Zusammenhang mit Affektstörungen, hierbei insbesondere die beiden n‑3‑Fettsäuren Eicosapentaensäure (EPA) und die Docosahexaensäure (DHA).
Eine spanische Studie, die Ende 1999 an der Universitätsklinik Navarra, Pamplona, begonnen wurde und noch nicht abgeschlossen ist (Stand Januar 2018), untersucht den Zusammenhang mediterraner Ernährungsweise und Depression und hatte im Mai 2005 schon mehr als 15.400 Probanden. Die mediterrane Ernährung gilt als besonders reich an EPA und DHA, Pyridoxin (B6), Folsäure (B9) und Cobalamin (B12). Die Wissenschaflter stellten fest, dass die n‑3‑reiche südeuropäische Ernährungsweise in der Lage ist, das Depressionsrisiko signifikant zu senken (Quelle: A. Sánchez-Villegas et al. 1999, Association of the mediterranean dietary pattern with the incidence of depression, University of Navarra, ArchGenPsy, 2009, 66 (10), JAMA Psychiatry, American Medical Association, USA/Chicago, http://archpsyc.jamanetwork.com/...).
Die Analyse einer groß angelegten Studie in Kombination mit Befragungen von 2005 bis 2008 in den USA ergab, dass die n‑3 Fettsäuren EPA und DHA generell einen depressionsmindernden Effekt haben, wobei nicht zwischen EPA und DHA unterschieden wurde (Quelle: C. A. Hoffmire et al. 2012, Associations between omega-3 polyunsaturated fatty acids from fish consumption and severity of depressive symptoms: An analysis of the 2005 - 2008 National Health and Nutrition Examination Survey, PLEFA, Vol. 86, 4/5-2012, S. 155 - 160, Elsevier, Amsterdam 2012, http://www.ncbi.nlm.nih.gov/...).
Der britische Psychiater und Ernährungsmediziner Julian G. Martins wählte aus 241 Arbeiten 28 geeignete für eine Meta‑Studie aus, die sich mit der Supplementierung von EPA und DHA im Zusammenhang mit einer Depression beschäftigten. Er fand heraus, dass vor allem EPA und weniger DHA für stimmungsaufhellende Effekte verantwortlich ist, wies jedoch darauf hin, dass es noch wesentlich besser durchgeführter Einzelstudien bedarf, um dieses Ergebnis zu verifizieren. Dies machten M. E. Sublette et al. in einer weiteren Meta‑Studie und kamen zum gleichen Ergebnis (Quellen: J. G. Martins 2009, EPA but not DHA appears to be responsible for the efficiacy of omega‑3 long chain polyunsaturated fatty acid supplementation in depression: evidence from a meta‑analysis of randomized controlled trials, Academy of Nutritional Medicine, Cambridge U. K., https://www.ncbi.nlm.nih.gov/pubmed/... und M. Elizabeth Sublette et al. 2011, Meta‑analysis of the effects of eicosapentaenoic acid (EPA) in clinical trials in depression, Journal of Clinical Psychiatry, 12/2011, 72 (12) S. 1577 - 1584, http://www.ncbi.nlm.nih.gov/...).
Es gibt auch Untersuchungen, die zu anderen Ergebnissen kommen (→ Erörterung der Harvard-Studie im folgenden Abschnitt 4.5).
Die physiologischen Ursachen einer Depression durch Magnesiummangel wollen Forscher der Universitätsklinik Wien nachgewiesen haben. Sie entdeckten zunächst Rezeptorkomplexe im Hypothalamus und der Amygdala, die sensibel auf einen Magnesiummangel reagieren und ihre Funktionen in diesem Falle einschränken. Bei den Versuchstieren, in diesem Falle Mäuse, wurde ein Verhalten beobachtet, das als depressiv bewertet wurde (Quelle: M. Ghafari, Gert Lubec et al. 2014, Dietary magnesium restriction reduces amygdala-hypothalamic GluN1 receptor complex levels in mice, Universitätskllinik für Kinder- und Jugendheilkunde Wien, Brain Structure and Function, 7/2015, 220 (4), Springer International Publishing AG, Cham/Schweiz, http://www.ncbi.nlm.nih.gov/...). Leider wurden entsprechende Rezeptoren beim Menschen noch nicht gefunden.
Zu einem ähnlichen Ergebnis kamen George A. Eby und Karen L. Eby aus Texas/USA in ihrer im Jahre 2006 veröffentlichten Untersuchung, die aber nur wenige Patientenfälle zitiert, bei denen eine Behandlung mit 125 bis 300 mg Magnesium erfolgreich Affektstörungen minderte. Die Studienautoren bemängelten einen allgemeinen Rückgang des Magnesiumangebots bzw. der ‑aufnahme durch den Konsum raffinierten Mehls oder den Verzicht einer Trinkwasseranreicherung. Zusammen mit einem erhöhten Magnesiumbedarf aufgrund von Stress und einer allgemein überproportionalen Kalziumaufnahme könne es zu einem Mangelzustand kommen, der eine Depression induziert. Die Autoren forderten zu weiteren Studien auf (Quelle: G. A. Eby, Karen L. Eby 2006, Rapid recovery from major depression using magnesium treatment, Medical Hypotheses, 2006, 67 (2), S. 362 - 370, www.ncbi.nlm.nih.gov).
Dass es einen Zusammenhang zwischen einer Depression und Eisenmangel gibt, scheint mittlerweile Konsens unter vielen Medizinern zu sein, und dennoch man findet kaum Studien, die sich mit der Frage nach der Qualität dieses Zusammenhangs beschäftigen.
Eine in der Schweiz und Deutschland durchgeführte Anwendungsbeobachtung untersuchte 873 Patienten, Frauen und Kinder, mit Eisenmangel und verschiedenen depressiven Symptomen, wie Stimmungstiefs, Erschöpfungszuständen, Konzentrations- oder Schlafstörungen. 86% der Patienten hatten keine Eisenmangelanämie trotz der Tatsache, dass bei der Hälfte von ihnen der Ferritinwert deutlich unter der Norm lag. Ihre Symptome sollen sich nach einer Behandlung mit Eisenpräparaten gebessert haben. Die Untersuchung ist allerdings nicht als unabhängig zu betrachten, da die untersuchenden Ärzte selbst Anbieter von Behandlungen mit Eiseninfusionen in der Schweiz sind (Quelle: Dr. med. Beat Schaub 2007, Iron Deficiency Depression, Institut für patientenorientierte Forschung IPF, Binningen/Basel, Schweiz, http://www.coaching-for-health.net/...).
In Japan kamen T. Sawada und sein Team bei einer nur an Frauen durchgeführten Untersuchung zu dem Ergebnis, dass Stimmung und Erschöpfung bei Eisenmangel durchweg schlechter bzw. ausgeprägter ist (Quelle: T. Sawada, A. Konomi, K. Yokoi 2014, Iron deficiency without anemia is associated with anger and fatigue in young Japanese women, Biological Trace Element Research, 6/2014, 159 (1-3), S. 22 - 31, http://www.ncbi.nlm.nih.gov/pubmed/...).
Jodmangel und seine negativen Auswirkungen auf Psyche und Nerven ist sehr gut erforscht und nachgewiesen, so dass entsprechende Studien nicht mehr zitiert werden müssen.
Bei der Recherche nach Studien, die sich mit dem Spurenelement Rubidium und affektiven Erkrankungen beschäftigen, wird man interessanterweise fündig, obwohl die Funktionen von Rubidium noch weitgehend unklar sind.
So berichtete ein 1978 im Journal of the Royal Society of Medicine erschienener Artikel über mehrere Studien, bei denen mittels Gabe von Rubidiumchlorid die extremen Schwankungen einer Bipolaren Störung geglättet und auch die manischen Phasen verlängert wurden (Quelle: Paschalis, Jenner, Lee 1978, Effects of rubidium chloride on the course of manic-depressive illness, Journal of the Royal Society of Medicine, 5/1978, 71 (5), S. 343 - 352, www.ncbi.nlm.nih.gov/pubmed/...).
1993 führten Ärzte der Psychiatrischen Klinik der Universität Turin in Italien eine zweimonatige Studie mit 20 Personen im Alter zwischen 46 und 64 Jahren durch, die an einer Depression bzw. Angststörung erkrankt waren. Die Medikation mit Rubidiumchlorid besserte mehrere Symptome signifkant. Es verbesserten sich die allgemeine Stimmungslage, Kreativität und Arbeitsfreude. Ebenfalls stellte man einen Rückgang der motorischen Verlangsamung fest bei nur mäßigen Nebenwirkungen (Quelle: R. Torta et al.: Rubidium chloride in the treatment of major depression, Minerva psichiatrica, 5/1993, 34 (2), S. 101 - 110, www.ncbi.nlm.nih.gov/pubmed/...).
3 Jahre später veröffentlichten zwei Wissenschaftler der Universtität Pavia in Italien eine Studie, bei denen 15 depressive Patienten drei Wochen lang täglich jeweils 540 mg Rubidiumchlorid erhielten und danach ein schneller und signifikanter Rückgang der depressiven Symptomatik verzeichnet wurde. Sie vermuteten einen postiven Effekt auf das Dopamin-System durch Rubidium (Quelle: Brundusino, Cairoli 1996, The pharmacological action of rubidium chloride in depression, Minerva psichiatrica, 3/1996, 37 (1), S. 45 - 49, www.ncbi.nlm.nih.gov/pubmed/...).
Exkurs: Die Trinkwasser-Studie aus Österreich
Eine Studie an der Medizinischen Universität Wien aus dem Jahr 2011 untersuchte die Auswirkungen des Trinkwassers auf die Selbstmordrate (Quellen: http://bjp.rcpsych.org/... und http://www.meduniwien.ac.at/...).
Gegenstand der Untersuchung waren die im Trinkwasser enthalteten Spuren von Lithium, die für eine niedrigere Suizidrate verantwortlich sein sollen. Zu einem ähnlichen Ergebnis kamen 2009 japanische Wissenschaftler, deren Studiendesign allerdings aufgrund ihres methodischen Vorgehens kritisiert wurde.
Lithium gilt als ein nicht-essentielles Spurenelement, wird jedoch als Medikament zur Behandlung von Affektstörungen, insbesondere bei manisch-depressiven Menschen, verordnet. Die pharmazeutischen Dosen sind jedoch um ca. das 100‑fache höher als die Mengen, um die es bei der Trinkwasseruntersuchung ging.
Nicht-essentielle Spurenelemente werden hier nicht erörtert, aus Vollständigkeitsgründen soll die Studie aber nicht unerwähnt bleiben, auch aufgrund des therapeutischen Einsatzes von Lithium, der in einem noch folgenden Abschnitt eine Rolle spielen wird (→ Kapitel 5).
4.4.5 Fazit: Mikronährstoffe und Affektstörungen
Bei der Bewertung ihrer Bedeutung für die Erkrankungsgenese schneiden nicht alle Mikronährstoffe gleich ab. Bei mehreren Substanzen kann man davon ausgehen, dass ihre Bedeutung im Falle einer Affektstörung höher als „gering“ zu bewerten ist. Zur Erinnerung im Vergleich dazu: Bei den Aminosäuren wurde festgestellt, dass das nach heutigem Wissensstand lediglich für eine Substanz, nämlich Tryptophan, gilt.
Über die Relevanz der Mikronährstoffe ist im Allgemeinen zu sagen:
- Ein ursächlicher Zusammenhang mit Affekterkrankungen ist bei allen Substanzen möglich, denn sämtliche von ihnen sind für die Funktionsfähigkeit des Zentralnervensystems von Bedeutung. Fast alle haben bei der Affektregulierung sogar eine unmittelbare Funktion.
- Für deren tägliche Aufnahme gibt es zwar Empfehlungswerte, beispielsweise von der Deutschen Gesellschaft für Ernährung, jedoch werden diese von Fachleuten verschiedener medizinischer Fachgebiete oder Ernährungswissenschaftlern, häufig kritisiert und es kursieren in der Literatur unterschiedliche Grenzwertangaben. Daher kann vor einer Mangelversorgung auch derjenige nicht sicher sein, der alle Grenzwerte einhält.
- Eine ausreichende Versorgung gemäß diesen Richtwerten scheint in Ländern der ersten Welt selbst bei ausgewogener Ernährung für einige Substanzen nicht sichergestellt.
- Generell besteht in Bezug auf Affektstörungen eine Unterversorgungsgefahr besonders bei den Vitaminen B2 (Riboflavin), B3 (Niacin), B9 (Folsäure) , B12 (Cobalamin) und der D‑Gruppe, bei der n‑3‑Fettsäure EPA, bei den Mineralstoffen Calcium und Magnesium und den Spurenelementen Eisen, Jod, Selen und Zink.
Insbesondere bergen folgende Umstände eine generelle Unterversorgungsgefahr:
- Allgemeine Mangelversorgung, beispielsweise in Entwicklungsländern.
- Einseitige Ernährung, Diäten oder Hungerkuren.
- Bei einer fettarmen Ernährung besteht eine Gefahr für die Versorgung mit fettlöslichen Vitaminen.
- Eine ungenügende Eiweißaufnahme gefährdet den Niacin-Status.
- Ein übermäßiger Verzehr bestimmter Nahrungsmittel kann zu einzelnen Mängeln führen.
- Besondere Vorsicht ist bei der Verwendung von Säuglingsnahrung geboten.
- Bei Vegetariern und besonders Veganern bestehen höhere Mangelgefahren für einzelne Stoffe.
- Regionale Besonderheiten sind zu beachten, vor allem ungenügende Bodenqualität.
- Jodmangelgefahr besteht generell in Hochgebirgslagen.
- Generell erhöhter Bedarf bei alten bzw. hochbetagten Menschen.
- Bei Obdachlosigkeit oder Verwahrlosung aufgrund ungenügender Nahrungsaufnahme.
- Heranwachsende, Schwangere, Stillende und Sportler bzw. bei Stress wegen des erhöhten Bedarfs.
Folgende Erkrankungen sind hinsichtlich einer allgemeinen Mikronährstoffunterversorgung so gut wie immer relevant:
- schwere Akuterkrankungen,
- Karzinome, Tumore und Chemotherapie bzw. Strahlentherapie,
- Intelligenzminderungen bzw. geistige Behinderung,
- Immunschwäche (insbesondere HIV/Aids),
- psychiatrische Erkrankungen, insbesondere Affektstörungen, Bulimie, Magersucht und Schizophrenie,
- Suchterkrankungen, insbesondere Alkoholismus,
- Erkrankungen des Verdauungssystems, insbesondere Darmerkrankungen,
- Erkrankungen von Nieren und Leber,
- Hämodialysen bei Niereninsuffizienz und
- nach Operationen.
Eine Unterversorgungsgefahr einzelner Mikronährstoffe besteht bei bestimmten Erkrankungen und therapeutischen Maßnahmen einschließlich der Einnahme bestimmter Medikamente. Diese Fälle sind in der umfangreichen Tabelle oben aufgezählt (→ Tabelle 8).
4.5 Fettsäuren- und Fettbegleitstoffmangel und Affektstörungen ▲
Abschnitt 2.4 beschreibt die Aufgaben von Fettsäuren und Fettbegleitstoffen im Nervensystem. Auf dieser Grundlage werden nun potentielle Zusammenhänge zwischen Versorgungsmängeln und Affektiven Störungen diskutiert.
Die Aufgaben der beiden n-3-Fettsäuren DHA, EPA und der Fettbegleitstoffe Phosphatidylcholin und Phosphatidylinositol sind Inhalte des vorigen Abschnitts 4.4, da sie traditionell als Mikronährstoffe betrachtet werden. Das gilt auch für die fettlöslichen Vitamine A, D, E und K, die manchmal als Fettbegleitstoffe bezeichnet werden.
Gesättigte Fettsäuren und ihre Bedeutung für die Affektverarbeitung
Bei gesättigten Fettsäuren steht die Energieversorgungsfunktion im Vordergrund. Aufgrund ihrer chemischen Struktur haben sie einen hohen Energiewert, was der Stoffwechsel optimal nutzen kann. Jedoch ist gerade die Energiebereitstellungsfunktion durch Fette in Nervenzellen irrelevant, denn dort wird Energie im Normalfall ausschließlich aus Glukose gewonnen. Die einzige Ausnahme ist der Hungerstoffwechsel, währenddessen fehlende Glukose durch Ketonkörper ersetzt wird.
Die für das Zentralnervensystem wichtige Funktion gesättigter Fettsäuren betrifft vor allem die Hirnzellmembranen, denen sie als Baustoffe dienen und die notwendige Stabilität verleihen.
Die in Abschnitt 2.4.1 erwähnten biologische Funktionen gesättigter Fettsäuren, die auf neueren und noch unsicheren Forschungen beruhen, betreffen zum größten Teil allgemeine Zellfunktionen. Die Kenntnisse sind noch lückenhaft. Träfen die Forschungsergebnisse zu, erhöhte sich die allgemeine Bedeutung gesättigter Fettsäuren für das Zentralnervensystem und wahrscheinlich auch für affektrelevante Hirnareale.
Die fast ausschließlich gegen gesättigte Fettsäuren geführte Diskussion wird ihren zweifelsfrei positiven Eigenschaften nicht immer gerecht.
TABELLE 9: FUNKTIONEN GESÄTTIGTER FETTSÄUREN IM ZENTRALNERVENSYSTEM
Fettsäure |
Zellmembranfunktion |
Affektrelevante biologische Funktionen (?) |
|---|---|---|
| Buttersäure | Membranstabilität | Derzeit keine bekannt |
| Caprinsäure | Membranstabilität | Derzeit keine bekannt |
| Laurinsäure |
Membranstabilität | Beteiligung an der Synthese mehrfach ungesättigter Fettsäuren |
| Myristinsäure | Membranstabilität | Beteiligung an der Zellkommunikation, Beteiligung an der Regulation der Verfügbarkeit mehrfach ungesättigter Fettsäuren |
| Palmitinsäure | Membranstabilität | Regulation der Hormonsynthese, Beteiligung an der Zellkommunikation |
| Stearinsäure | Membranstabilität | Derzeit keine bekannt |
Tabelle 9: Die Gewährleistung der Stabilität von Nerven- und Gliazellmembranen ist eine wichtige Funktion aller gesättigter Fettsäuren und relativiert ihre Dämonisierung als „schlechte“ Fette. Darüber hinaus könnten sie auch weitere biologische Funktionen erfüllen, die man bisher fast ausschließlich mit den ungesättigten „guten“ Fettsäuren in Verbindung bringt, jedoch ist das noch nicht endgültig gesichert (Quelle: EUFIC, http://www.eufic.org/GesFS).
Einfach ungesättigte Fettsäuren und ihre affektrelevanten Funktionen
Der Körper benötigt für den Aufbau der Zellmembranen einfach ungesättigte Fettsäuren, sie verleihen ihnen im Gegensatz zu den gesättigten Fettsäuren die nötige Flexibilität und Beweglichkeit und ermöglichen den in Zellwänden eingebauten Proteinen eine optimale Funktionsfähigkeit als Rezeptoren. Ein bestimmter Teil der Nahrung muss daher aus einfach ungesättigten Fettsäuren bestehen. Eine häufig in der Nahrung vorkommende einfach ungesättigte Fettsäure ist die Ölsäure.
Für die auf Grundlage der Ölsäure vom Körper selbst hergestellte Nervonsäure werden weitere biologische Funktionen vermutet, die im Zentralnervensystem relevant sind. Pflanzen bzw. Pflanzensamen enthalten selten Nervonsäure. Eine Baumart der Malania-Gattung aus China enthält Nervonsäure, ebenfalls findet man im Borretschsamenöl einen geringen Nervonsäureanteil.
Die Auswirkungen einfach ungesättigter Fettsäuren auf die Membranfunktionalität spielen im gesamten Gehirn eine Rolle und damit auch in den für Affekte relevanten Hirnregionen.
TABELLE 10: WICHTIGE EINFACH UNGESÄTTIGTE FETTSÄUREN IM ZENTRALNERVENSYSTEM
Fettsäure |
Zellmembranfunktion |
Affektrelevante biologische Funktionen |
|---|---|---|
| Gadoleinsäure | Membranflexibilität | Derzeit keine bekannt |
| Nervonsäure | Membranflexibilität, in Hirnzellen Vorkommen erhöht |
Myelinsynthese, Modulierung der Reizübertragung, Beteiligung an Wachstums- und Verschaltungsvorgängen der Nervenzellen, wirkt gegen Neurodegeneration |
| Palmitoleinsäure | Membranflexibilität | Derzeit keine bekannt |
| Ölsäure | Membranflexibilität | Synthese der Nervonsäure |
Tabelle 10: Auch bei einfach ungesättigten Fettsäuren stehen deren Membranfunktionen für das Nervensystem im Vordergrund, wobei die auf Basis der Ölsäure im Körper synthetisierte Nervonsäure dort auch weitere biologische Funktionen erfüllt.
Mehfach ungesättigte Fettsäuren und ihre affektrelevanten Funktionen
Wie die einfach ungesättigten Fettsäuren sorgen mehrfach ungesättigte Fettsäuren in Zellmembranen für ausreichende Flexibilität. Ihre sonstigen biologischen Funktionen haben eine vergleichbar hohe Bedeutung.
Eine direkte Beteiligung an Nervenfunktionen ist bei der Eicosapentaensäure (EPA) nachgewiesen. Indirekt betrifft das damit auch die Alpha-Linolensäure, die zu einem geringen Teil in EPA umgewandelt wird (→ Abschnitt 4.4.1 ff.).
Die n-6-Fettsäuren Linolsäure, Gamma-Linolensäure, Dihomogamma-Linolensäure und Arachidonsäure spielen bei der Synthese von Eicosanoiden eine Rolle und haben damit ggf. indirekt auch für Affekte eine Bedeutung. Es ist nicht ausgeschlossen, dass Eicosanoide hier Aufgaben übernehmen, allerdings sind sie noch wenig erforscht.
Für Affekte könnten auch Endocannabinoide von Bedeutung sein, die auf Basis der Arachidonsäure synthetisiert werden.
Eine wichtige biologische Funktion haben mehrfach ungesättigte Fettsläuren in der Entzündungsbekämpfung.
TABELLE 11: MEHRFACH UNGESÄTTIGTE FETTSÄUREN IM ZENTRALNERVENSYSTEM
Fettsäure |
Zellmembranfunktionen |
Affektrelevante biologische Funktionen |
|---|---|---|
| Alpha-Linolensäure |
Membranflexibilität | DHA- und EPA-Synthese |
| Docosahexaensäure (DHA) | Membranflexibilität, in Hirnzellen Vorkommen erhöht |
Myelin-Synthese |
| Eicosapentaensäure (EPA) |
Membranflexibilität | Mitwirkung an der Reizübertragung, Synthese der Serie-3-Eicosanoide |
| Linolsäure | Membranflexibilität | Synthese von Eicosanoiden (?) |
| Gamma-Linolensäure | Membranflexibilität, in Hirnzellen Vorkommen erhöht |
Synthese von Eicosanoiden (?) |
| Dihomogamma-Linolensäure | Membranflexibilität | Arachidonsäure-Synthese (?) Synthese von Eicosanoiden (?) |
| Arachidonsäure | Membranflexibilität | Synthese von Eicosanoiden (?) Synthese von Endocannabinoiden (?) |
Tabelle 11: Von den mehrfach ungesättigten Fettsäuren haben nur die zur n-3-Gruppe zählende Alpha-Linolensäure sowie DHA und EPA nachgewiesene biologische Funktionen, die Auswirkungen auf Affekte bzw. affektive Erkrankungen haben können.
Absolute und relative Bedarfsempfehlungen für Fettsäuren
Ähnlich wie bei Vitaminen, Mineralstoffen, Spurenelementen und Proteinen empfehlen Fachleute und einschlägige Institutionen Tagesbedarfe einzelner Fettsäuren.
Im Unterschied zu den meisten anderen Substanzen ist bei der Aufnahme der verschiedenen Fettsäuren wegen ungünstiger Verdrägungseffekte grundsätzlich auf bestimmte Mengenverhältnisse zu achten. Es genügt also nicht, sich nur an die Mindest- oder Höchstgrenzen einzelner Substanzen zu halten.
Die Vorgaben der verschiedenen Institute weichen in gewohnter Weise teilweise voneinander ab. Die Deutsche Gesellschaft für Ernährung e. V. (DGE) empfiehlt die Aufnahme von Fetten auf Basis der prozentualen Zufuhr der Nahrungsenergie im Vergleich mit Kohlenhydraten und Proteinen. Das macht es auf den ersten Blick schwierig, absolute Mengen zu ermitteln, was durch die Angabe von Bandbreiten bei den Nährmitteln noch erhöht wird.
TABELLE 12: DGE-EMPFEHLUNGEN FÜR DIE NAHRUNGSENERGIEAUFNAHME ERWACHSENER
Nährstoffe |
Zufuhr in % der Nahrungsenergie |
Mengenverhältnisse der Fettsäuren |
|---|---|---|
| Kohlenhydrate |
> 50% der Nahrungsenergie | --- |
| Proteine | 9 - 11% der Nahrungsenergie | --- |
| Fette |
<= 30% der Nahrungsenergie | Gesättigte Fettsäuren <= 10% der Nahrungsenergie Einfach ungesättigte Fettsäuren > 10% der Nahrungsenergie Mehrfach ungesättigte Fettsäuren 7 - 10% der Nahrungsenergie Linolsäure (n-6) : Alpha-Linolensäure (n-3) = 5 : 1 Schwangere + Stillende > 200 mg/Tag DHA zusätzlich Zur HKK*-Prävention insgesamt 250 mg/Tag DHA und EPA |
Tabelle 12: Die Ernährungsempfehlungen der DGE beziehen sich auf einen GESUNDEN Erwachsenen ab dem 25. Lebensjahr bis unter 51 Lebensjahren. *) HKK = Herz-Kreislauf-Erkrankungen (Quelle: DGE e. V., http://www.dge.de).
Die FoodDrinkEurope (FDE), bis 2011 Confédération des Industries Agro-Alimentaires de l'Union Européenne CIAA, gibt folgende Richtwerte für den Fettkonsum gesunder Erwachsener an, jedoch getrennt für Frauen und Männer und mit konkreteren Angaben in Gramm und ohne Bandbreiten (→ Tabelle 13).
TABELLE 13: FDE-EMPFEHLUNGEN ERWACHSENE FRAUEN UND MÄNNER
Fettsäure(n) bei 30%-Anteil an der Nahrungsenergie |
Empfehlungen für Frauen |
Empfehlungen für Männer |
|---|---|---|
| Gesättigte Fettsäuren |
20 gr/Tag | 30 gr/Tag |
| Einfach ungesättige Fettsäuren | 34 gr/Tag | 29 gr/Tag |
| Mehrfach ungesättige n-3-Fettsäuren davon Alpha-Linolensäure davon DHA und EPA |
2,2 gr/Tag 2,0 gr/Tag 0,2 gr/Tag |
2,7 gr/Tag 2,5 gr/Tag 0,2 gr/Tag |
| Mehrfach ungesättige n-6-Fettsäuren (Linolsäure) | 14 gr/Tag | 18 gr/Tag |
| Gesamtmenge des Nahrungsfetts | 70,2 gr/Tag | 79,7 gr/Tag |
Tabelle 13: Auch die Ernährungsempfehlungen der FDE beziehen sich auf einen Anteil des Fetts an der gesamten Nahrungsenergie von 30%, jedoch werden konkrete Mengen in Gramm genannt. Das Verhältnis der n-6 zu n-3-Fettsäuren betrüge laut FDE idealerweise 6,4:1 bei Frauen und 6,7:1 bei Männern (Quelle: http://www.fooddrinkeurope.eu).
Fettbegleitstoffe und affektrelevante Funktionen
Informationen über potentielle Zusammenhänge zwischen Phosphatidylcholin bzw. -inositol mit Affekten werden im vorigen Abschnitt 4.4 erörtert, Hinweise zur optimalen bzw. „richtigen“ Cholesterinmenge in der Nahrung bzw. im Körper und Störungen sind Inhalte des Abschnitts 2.4. Tabelle 14 stellt affektrelevante Funktionen der Fettbegleitstoffe nochmal in der Übersicht dar.
TABELLE 14: FETTBEGLEITSTOFFE IM ZENTRALNERVENSYSTEM
Fettbegleitstoff |
Affektrelevante Zellmembranfunktionen |
Sonstige affektrelevante Funktionen |
|---|---|---|
| Phosphatidylcholin |
Membranflexibilität, in Hirnzellen Vorkommen erhöht |
Acethycholin-Synthese, Homocystein-Abbau |
| Phosphatidylinositol | Membranflexibilität, Nervenreizübertragung, Inositoltriphosphat IP3 als Second messenger |
Acetylcholin-Synthese, Serotonin-Synthese |
| Phosphatidylserin |
Membranflexibilität, besondere räumliche Nähe zu Membranproteinen |
Antioxidans-Funktion (?) |
| Cholesterin | Membranstabilität, in Hirnzellen Vorkommen erhöht |
Vorstufe aller Steroidhormone, Synthese von Vitamin D |
Tabelle 14: Übersicht über die Fettbegleitstoffe, die empfohlenen Tagesmengen sind Tabelle 7 zu entnehmen. Weitere Informationen über Cholesterin sind Inhalte des Abschnitts 2.4.
Gefahr von Mangelversorgungen
Fettmangelversorgungen sind in westlichen Ländern naturgemäß selten. Dennoch kommen sie bei folgenden Ernährungsgewohnheiten und chronischen Erkrankungen vor:
- Fettarme Ernährung
- Hungerkuren, (Heil-)Fasten, Null-Diät
- Einnahme von Fett-Blockern bzw. fettbindenden Medikamenten
- Einnahme cholesterinsenkender Medikamente (Statine)
- Vegetarismus und Veganismus, insbesondere hinsichtlich der Versorgung mit n‑3‑Fettsäuren
- Mischköstler aufgrund eines Überangebotes von n‑6‑Fettsäuren in Relation zu n‑3‑Fettsäuren
- Schwere Akuterkrankungen
- Karzinome, Tumore und während einer Chemotherapie bzw. Strahlentherapie
- Intelligenzminderungen bzw. geistige Behinderung
- Immunschwäche (insbesondere HIV/Aids)
- Psychiatrische Erkrankungen, insbesondere Affektstörungen, Bulimie, Magersucht und Schizophrenie
- Suchterkrankungen, insbesondere Alkoholismus
- Erkrankungen des Verdauungssystems, insbesondere Darmerkrankungen
- Nach operativen Eingriffen
Eine Ausnahme bildet jedoch die Gruppe der n‑3‑Fettsäuren, denn auch in hiesigen Breiten erleiden viele gut ernährte und gesunde Mischköstler einen n‑3‑Fettsäurenmangel aufgrund des Überangebotes von n‑6‑Fettsäuren in der Nahrung. Ernährungswissenschaftler weisen seit Jahren darauf hin, dass die Versorgung der Bevölkerung mit diesen wichtigen Substanzen auch in Industrieländern gefährdet ist. Weitere Informationen liefert beispielsweise der Arbeitskreis Omega-3 e. V. (http://www.ak-omega-3.de/). Hier findet man eine Zusammenfassung der Ergebnisse der Nationalen Verzehrsstudie NVS II zu diesem Thema: https://www.bmel.de/....
Die Gründe für die allgemeine Unterversorgung liegen u. a. in einem gesunkenen Fischkonsum der Bevölkerung und der Tatsache, dass zu wenig hochwertige Öle konsumiert werden, die reich an n‑3‑Fettsäuren sind, beispielsweise Lein- oder Rapsöl (→ Ausführungen zur Unterversorgung mit den n‑3‑Fettsäuren DHA und EPA in Abschnitt 4.4).
Dazu gesellt sich das Problem einer unzureichenden Ernährung des Weideviehs in der Milchwirtschaft in vielen Ländern, aufgrund dessen der Anteil der n‑3‑Fettsäuren in allen Milchprodukten immer weiter zurückgeht. Statt einer natürlichen Ernährung mit Gräsern erhalten Milchkühe eine Ernährung mit Mais, Soja oder anderen artfremden Nährmitteln. Dadurch sinkt nicht nur die Qualität ihrer Milch. Die Tiere erleiden häufig auch Krankheiten, die bei artgerecht ernährtem Weidevieh nicht auftreten, und das Leben der Tiere stark beeinträchtigen. Tierschutzverbände brandmarken dies zu Recht als Tierquälerei. Sowohl aus Ernährungs- als auch Tierschutzgründen sollten daher ausschließlich Weidemilchprodukte konsumiert werden.
Studienlage: Auswirkungen von Fetten und Fettbegleitstoffen auf Affekte bzw. bei Affekterkrankungen
Studien über die beiden wichtigsten Vertreter der n-3-Gruppe DHA und EPA und über Phosphatidylinositol sind im vorigen Abschnitt 4.4 beschrieben. Zahlreiche Untersuchungen kommen zu einer positiven Bewertung der Einflüsse dieser Substanzen auf Affekte und im Falle affektiver Erkrankungen.
Nun geht es um emprische Erkenntnisse über andere mehrfach ungesättigte Fettsäuren beim Einsatz tagesüblicher Dosen.
Einen Artikel über die generelle Bedeutung der Gruppe der n‑3‑Fettsäuren für Hirnfunktionen und Affektverarbeitung findet man in der Pharmazeutischen Zeitung der Ausgabe 9/2011. Auch hier wird darauf verwiesen, dass die Versorgung der Bevölkerung in Industrieländern unzureichend ist. Tierversuchsstudien haben ergeben, dass eine Mangelversorgung mit n‑3‑Fettsäuren zu massiven Veränderungen in affektverarbeitenden Hirnregeionen führt: „Eine lebenslange Ernährung, die arm an Omega-3-Fettsäuren ist, stört die synaptische Plastizität in Gehirnteilen, die für die emotionale Kontrolle verantwortlich sind. Depressives Verhalten ist, zumindest bei Mäusen, das Resultat.“ (Quelle: Christina Hohmann, Omega‑3‑Fettsäuren für Hirnfunktion, Pharmazeutische Zeitung online, Eschborn 2011, http://www.pharmazeutische-zeitung.de/...).
An der Harvard University in Boston/USA wurden von 1996 bis 2006 Untersuchungen an 54.632 Frauen ab 50 Jahren durchgeführt, die zu Beginn der Studie depressionsfrei waren. In diesem Zeitraum dokumentierte man 2.823 Erkrankungsfälle und es ergaben sich interessante Zusammenhänge mit der Alpha‑Linolensäure und der Linolsäure, wobei die Erkenntnisse der parallel untersuchten Substanzen aus Fischöl, DHA und EPA, den Ergebnissen anderer Studien widersprachen.
Man stellte nämlich fest, dass Fischöle keinerlei schützende Effekte hatten, wohl jedoch der Konsum von Pflanzenölen, die reich an der n‑3‑Fettsäure Alpha‑Linolensäure waren. Weiter ergab die Studie, dass dieser Effekt umso höher war, je weniger die Probandinnen von der n‑6‑Fettsäure Linolsäure konsumierten (Quelle: Lucas M., Mirzaei F., O'Reilly E. J. et al., Dietary intake fo n‑3 and n‑6 fatty acids and the risk of clinical depression in women: a 10‑y prospective follow‑up study, The American Journal of Clinical Nutrition, 6/2011, S. 1337 ‑ 1343, http://www.ajcn.nutrition.org/...).
Zu einem positiven Urteil hinsichtlich der beiden n‑6‑Fettsäuren Linolsäure und Gamma‑Linolensäure bzw. Ölsäure kam dagegen eine randomisierte und placebokontrollierte Doppelblind-Studie aus Brasilien über die Behandlung des Prämensturellen Syndroms (PMS) an 120 erkrankten Frauen. Die Patientinnen bekamen entweder eine einfache (1 gr) oder doppelte Dosis (2 gr) bzw. das Placebo. Die PMS‑Symptomatik besserte sich signifikant in Abhängigkeit der Dosis, das heißt die Patientinnen mit der doppelten Dosis profitierten stärker (Quelle: Rocha Filho E. A., Lima J. C. et al., Essential fatty acids for premenstural syndrome and their effect on prolactin and total cholesterol levels: a randomized, double blind, placebo‑controlled study, Centro de Ciências da Saùde, Universidade Federal de Pernamubco, Recife, Brasil, Reproductive Health Journal 1/2011, doi:10.1186/1742‑4755‑8‑2, http://www.reproductive-health-journal.com/...).
In den folgenden Untersuchungen geht es um Zusammenhänge zwischen tagesüblichen Dosen von Phosphatidylserin und Affektstörungen. Leider gibt es nicht sehr viele Untersuchungen über Zusammenhänge mit Affekten, denn Phosphatidylserin wird eher im Zusammenhang mit der Verbesserung allgemeiner kognitiver Leistungen und Demenz in Studien getestet.
Maggioni et al. untersuchten die Wirkung oraler 300 mg Phosphatidylserin-Gaben täglich auf depressive ältere Patientinnen. Dabei stellen sie nach 30 Tagen eine Besserung der depressiven Symptomatik fest, zuvor wurde den Teilnehmerinnen 10 Tage lang ein Placebo verabreicht. Verschiedene Diagnosetests wurden vor bzw. unmittelbar nach der Placebo-Gabe und nach Beendigung der Studie durchgeführt. Die Untersuchung umfasste nur wenige Teilnehmerinnen, was ihren Aussagewert schmälert (Quelle: Maggioni M., Picotti G. B. et al., Effects of phosphatidylserine therapy in geriatric patients with depressive disorders, Acta Psychiatrica Scandinavica, 3/1990, S. 265 - 270, http://www.ncbi.nlm.nih.gov/pubmed/...).
Einen höheren Aussagewert hat eine Phosphatidylserin-Studie aus dem Jahre 1993, die 494 ältere Patienten zwischen dem 65. und 93. Lebensjahr beiderlei Geschlechts bezüglich ihrer kognitiven Leistungen und Verhaltensänderungen analysierte. Die Dosis betrug ebenfalls 300 mg/Tag. Die Untersuchungen der Teilnehmer erfolgten vor Beginn und nach dem 3. bwz. 6. Monat. Die kognitiven Leistungen und die Stimmung in der Wirkstoff-Gruppe verbesserten sich, so dass es dort auch zu positiven Änderungen des Verhaltens kam (Quelle: Cenacchi T., Bertoldin T., Farina C. et al., Cognitive decline in the elderly: a double‑blind, placebo‑controlled multicenter study on efficacy of phosphatidylserine administration, Aging/Milano, 4‑1993, S. 123 ‑ 133, http://link.springer.com/...).
1996 wurde an 30 Teilnehmern getestet, ob es durch die Einnahme von 200 mg Phosphatidylserin täglich zu einer Verbesserung der Beta-Endophin-Werte (beta-EP) und einer Stimmungaufhellung kommt. Obwohl sich die Stimmung der Teilnehmer besserte, die den Wirkstoff erhielten, konnte man hinsichtlich einer Erhöhung der Beta-EP-Werte keine Änderungen feststellen (Quelle: Brambilla, Maggioni, Cenacchi et al., Beta-endorphin concentration in peripheral blood mononuclear cells of elderly depressed patients-effects of phosphatidylserine therapy, Neuropsychobiology, 1996, 34 (1), S. 18 - 21, http://www.ncbi.nlm.nih.gov/pubmed...).
Zu Phosphatidylserin merkt die Pharmazeutische Zeitung an: „Niedrige Werte von Phosphatidylserin im Gehirn werden mitunter mit verschlechterter mentaler Funktion und Depressionen in Zusammenhang gebracht. Diese Symptome findet man häufig bei älteren Menschen, die oft eine unzureichende Versorgung mit diesen Nährstoffen haben. In einer Doppelblindstudie an Sportlern untersuchte man den Einfluss von Phosphatidylserin auf den Hormonspiegel. Die Verumgruppe erhielt zwei Wochen lang täglich 800 mg Phosphatidylserin, die andere Placebo. Unmittelbar nach dem Training wurden der Cortison- und der Testosteronspiegel gemessen sowie die mentale Situation erfasst. Die Verumgruppe wies durchgängig einen deutlich geringeren Cortisonwert auf. Das Absinken des Testosteronspiegels nach dem Training war stark verringert, und die Trainingsmentalität wurde als verbessert empfunden.“ Vom Verfasser Wilfried Dubbels wurde bemängelt, dass weder die Anzahl der Probanden noch die Studiendauer ausreichend gewesen seien, um verlässliche Aussagen zu treffen. Der Autor bezieht sich auf folgende Studie: Fahey, T. D. et al., Hormonal effects of phosphatidylserine during 2 weeks of intense training, National Meeting of the American College of Sports Medicine, 6/1998, Orlando, Florida/USA, der Artikel erschien in der Ausgabe 10/2004 der Pharmazeutischen Zeitung (Titel: Vorsicht vor der Prohormon-Falle, http://www.pharmazeutische-zeitung.de/...).
Zu ähnlichen Ergebnissen kam eine US-amerikanische Studie aus dem Jahre 2008, die jedoch auch nur eine geringe Zahl von Probanden einschloss (Quelle: Starks M. A,, Jäger R. et al., The effects of phosphatidylserine on endocrine response to moderate intensity exercise, Journal of the International Society of Sports Nutrition 2008, 5:11 doi:10.1186/1550-2783-5-11, http://www.jissn.com/...).
Studiendokumentationen über die Beziehungen zwischen Cholesterin und Affekten bzw. Affektstörungen findet man in zahlreichen fach- und populärwissenschafltichen Medien.
Einen Zusammenhang zwischen Blutcholesteringehalt und Depression/Angstzuständen stellte Edward C. Suarez 1999 in seiner Studie bei 121 Frauen fest. Es ergaben sich keine Zusammenhänge beider Merkmale mit dem „guten“ HDL‑Cholesterin, jedoch beim Gesamtcholesterinspiegel. Es zeigten sich für beide Merkmale umgekehrte Relationen. Bei einem Cholesterinspiegel von unter 160 mg/dl neigten die Probandinnen eher zu Depressions- und Angstsymptomen. Suarez bewertete das Risiko bei niedrigen Werten als gut doppelt so hoch im Vergleich mit normalen oder erhöhten Werten. Die Merkmale wurden anhand des NEO-Persönlichkeitstests nach Costa/McCrae und dem Persönlichkeitstest nach Spielberger (STPI) untersucht (Quelle: Edward C. Suarez, Relations of Trait Depression and Anxiety to Low Lipid and Lipoprotein Concentrations in Healthy Young Adult Women, Psychosomatic Medicine 1999, 61, S. 273 – 279, http://www.ncbi.nlm.nih.gov/pubmed/...).
Eine relativ aktuelle und aufwändige Untersuchung aus Frankreich („ESPRIT-Studie“) kam zu unterschiedlichen Ergebnissen in Bezug auf das Geschlecht. Während bei Frauen ein zu niedriger HDL‑Cholesterinwert mit der Gefahr in Zusammenhang gebracht werden kann, an einer Depression zu erkranken, scheint das bei Männern eher auf einen niedrigen LDL‑Wert zuzutreffen. Um zu diesem Ergebnis zu gelangen, wurden insgesamt 1.792 Personen mit einem Alter ab 65 Jahren sieben Jahre lang begleitet (Quellen: http://www.elsevier.com/... oder als Pdf zum Herunterladen mit weiteren Details und Quellenhinweisen: Ancelin M.-L., Carrière I., Boulenger J.-P., Malafosse A., Stewart R. et al., 2010, Gender and genotype modulation of the association between lipid levels and depressive symptomatology in community-dwelling elderly, University of Montpellier, CHU Montpellier, University Hospital and School of Medicine of Geneva/University of Geneva, King's College London/Institute of Psychiatry, https://hal.archives-ouvertes.fr/...).
Auch ein möglicher Zusammenhang zwischen vollzogenen Selbstmorden oder Selbstmordanfälligkeit mit Cholesterin wird häufig untersucht. Studien deuten darauf hin, dass ein niedriger Cholesterinwert und Suizid etwas miteinander zu tun haben könnten. Es gibt aber auch Studien, die zu einem gegenteiligen Ergebnis kommen. R. A. Sansone versucht diese Ergebnisse in der Psychiatry-Online-Ausgabe zu erklären und kommt zu dem Schluss, dass beide Möglichkeiten bestehen und nur ein bestimmter Kreis von Personen bei einem niedrigen Cholesterinspiegel für Suizid oder Suizidgedanken empfänglich ist (Quelle: http://www.ncbi.nlm.nih.gov/...).
Cholesterinsenkende Mittel (Statine), die bei Patienten mit hohem Cholesterinspiegel verordnet werden, und deren potentielle Auswirkungen auf Affekte sind diskussionswürdig. Folgende Studien sind relevant: Steffens D. C., McQuoid D. R., Krishnan K. R, Cholesterol-lowering medication and relapse of depression, Psychopharmacol Bull 2003; 37 (4), S. 92 ‑ 98, http://www.ncbi.nlm.nih.gov/...; Knashawn Morales et al., Simvastatin Causes Changes in Affective Processes in Elderly Volunteers, Journal of the American Geriatrics Society, 2006 (54), S. 70, http://onlinelibrary.wiley.com/...; Young‑Xu Y. et al., Long‑term statin use and psychological well‑being, University of Pennsylvania, 8/2003, 20; 42(4), S. 690 ‑ 697, http://www.ncbi.nlm.nih.gov/...).
Die ersten beiden Studien ergaben einen deutlichen Zusammenhang zwischen der Einnahme von Statinen und dem Risiko, erstmals an einer Depression zu erkranken bzw. einen Rückfall zu erleiden. Sie wurden an 234 (Steffens et al.) bzw. 80 (Morales et al.) älteren Patienten durchgeführt.
Die Studie von Young‑Xu et al. auf der Basis von 371 Patienten ergab hingegen einen genau umgekehrten Zusammenhang. In der Gruppe der 140 Patienten, die vier Jahre kontinuierlich Statine einnahmen, zeigte sich ein niedrigeres Erkrankungsrisiko für eine Depression im Vergleich mit 231 Patienten, die solche Präparate nicht verwendeten. Interessant bei dem Studienergebnis ist, dass es keine Beziehung zwischen den positiven Effekten der Statine, also der Cholesterinsenkung, und den Affektveränderungen gab. Das heißt, dass die Verbesserungen der Affekte nicht mit der Senkung des Cholesterinwertes im Zusammenhang stehen können und auf andere Umstände zurückzuführen sind.
Fazit: Fettsäuren und Affekte bzw. Affektstörungen
Bei der Versorgung mit Fettsäuren kommt es auf Menge und Ausgewogenheit nur dreier Arten an: gesättigte, einfach ungesättigte und mehrfach ungesättigte Fettsäuren. Die Aufgaben der Fettsäuren im Zentralnervensystem und bei der Affektverarbeitung sind auf relativ wenige, aber wesentliche Funktionen beschränkt.
Folgende Unterschiede bestehen zu anderen Substanzen:
- Ihre Hauptaufgaben erfüllen Fettsäuren mit dem Aufbau und der Erhaltung der Zellmembranstrukturen. Sie sind damit indirekt auch für die Funktionsfähigkeit der in die Membran integrierten Proteine, beispielsweise Rezeptoren, verantwortlich und für die Funktionstüchtigkeit der Zellen insgesamt. Ihre Bedeutung für Affekte ergibt sich aufgrund der Aufgaben, die Membranproteine bei der Reizübertragung und Reizweiterleitung erfüllen und für die intakte Membranstrukturen unerlässlich sind.
- Beim Fettsäurenkonsum kommt es vor allem auf ihr Mengenverhältnis untereinander an. Mit einem optimalen Nahrungsangebot in Bezug auf dieses Verhältnis ist der Körper in der Lage, auch die Anteile der Fettsäuren in den Zellmembranen optimal zu gestalten (→ Tabellen 12 und 13). Dabei scheint ein Verhältnis der Fettsäuren n-3 : n-6 von 1: 5 eine Rolle zu spielen.
Studien zeigen, dass insbesondere eine n-3-Mangelversorgung Affekte negativ beeinflusst und die Versorgung der Bevölkerung mit n-3-Fettsäuren ist auch in westlichen Industrieländern nicht optimal ist.
Nachgewiesene eigenständige biologische Funktionen betreffen die beiden Fettsäuren Docosahexaensäure (DHA) und insbesondere die Eicosapentaensäure (EPA). Zahlreiche Studien belegen deren positive Auswirkungen auf Affekte bzw. Affektstörungen (→ Abschnitt 4.4.4).
Fazit: Fettbegleitstoffe und Affekte bzw. Affektstörungen
Auch die Fettbegleitstoffe Phosphatidylserin und Cholesterin erfüllen wenige, dennoch wichtige Funktionen im Zentralnervensystem mit Auswirkungen auf Affekte (Phosphatidylcholin, Phosphatidylinositol und die fettlöslichen Vitamine A, D, E und K wurden in Abschnitt 4.4 diskutiert):
- Phosphatidylserin hat, wie fast alle Phospholipide, eine hohe Bedeutung als flexibilisierender Baustoff für Zellmembranen des Zentralnervensystems und ähnelt funktionell betrachtet einer ungesättigten Fettsäure. Die Frage, ob Phosphatidylserin im Vergleich mit anderen Membranbestandteilen wichtiger ist, kann nicht klar beantwortet werden. Einige Studienergebnisse deuten darauf hin, dass die Substanz stärkere Auswirkungen auf Affekte haben könnte.
- Cholesterin hat aufgrund seines hohen Vorkommens im Gehirn und seiner wichtigen Membranstabilisierungsfunktion für sämtliche Hirnleistungen eine hohe Bedeutung. Zahlreiche Studien belegen, dass ein niedriger Cholesterinspiegel mit Affekterkrankungen einhergehen kann. Das gilt im übertragenen Sinne auch für cholesterinsenkende Medikamente (Statine). Studien scheinen zu bestätigen, dass sich Affektstörungen unter der Einnahme von Statinen verstärken.
4.6 Wassermangel und Affektstörungen ▲
Die biologische Bedeutung des Wassers ist in Kapitel 2 beschrieben: Wasser ist ein wichtiger Körperbestandteil, dient als Lösungs- und Transportmittel, ermöglicht den osmotischen Druckausgleich, die Verdauung und die Wärmeregelung des Körpers (→ Abschnitt 2.6).
Im Körper übernimmt Wasser damit Basisaufgaben und ist von allgemeiner Bedeutung. Als Einzelsubstanz unterscheidet es sich von anderen Kausalfaktoren, bei denen verschiedene Einzelsubstanzen eine Gruppe bilden.
Wasserbedarf
Der individuelle Wasserbedarf hängt von der jeweiligen Lebensituation ab: Lebensalter, Umgebungstemperatur oder Grad der körperlichen Anstrengung. Auch akute oder chronische Erkrankungen spielen unter Umständen eine Rolle.
Stellvertretend für die Bedarfsempfehlung verschiedenener Institute und Organisationen soll hier auf die Empfehlungen der Deutschen Gesellschaft für Ernährung e. V. (DGE) verwiesen werden, die sich bei Annahme einer durchschnittlichen Lebenssituation auf das Lebensalter als wichtigstem Einflussfaktor beziehen.
TABELLE 15: WASSERBEDARF IN ABHÄNGIGKEIT VOM LEBENSALTER
Bevölkerungsgruppe |
Wasserzufuhr pro kg/Tag durch Getränke und feste Nahrung in ml |
Absolute Wasserzufuhr durch Getränke und feste Nahrung in ml |
|---|---|---|
| Säuglinge bis zum vollendeten 4. Monat | 130 |
620 |
| Säuglinge vom 4. bis zum vollendeten 12. Monat | 110 |
900 |
| Kinder vom 1. bis zum vollendeten 4. Jahr | 95 |
1.170 |
| Kinder vom 4. bis zum vollendeten 7. Jahr | 75 |
1.420 |
| Kinder vom 7. bis zum vollendeten 10. Jahr | 60 |
1.570 |
| Kinder vom 10. bis zum vollendeten 13. Jahr | 50 |
1.880 |
| Kinder vom 13. bis zum vollendeten 15. Jahr | 40 |
2.140 |
| Jugendliche vom 15. bis zum vollendeten 19. Jahr | 40 |
2.450 |
| Erwachsene vom 19. bis zum vollendeten 25. Jahr | 35 |
2.360 |
| Erwachsene vom 25. bis zum vollendeten 51. Jahr | 35 |
2.270 |
| Erwachsene vom 51. bis zum vollendeten 65. Jahr | 30 |
1.970 |
| Erwachsene ab dem 65. Jahr | 30 |
1.990 |
| Schwangere | 35 |
2.360 |
| Stillende | 45 |
2.710 |
Tabelle 15: Die Richtwerte stammen von der Deutschen Gesellschaft für Ernährung e. V. (DGE). Die absolute Wasserzufuhr in der rechten Spalte bezieht sich auf normalgewichtige Personen (Quelle: http://www.dge.de).
Potentielle Auswirkungen eines Flüssigkeitsmangels auf Affekte
Ein Flüssigkeitsmangel im Körper (Dehydrierung) kann sich grundsätzlich bei allen Körperfunktionen negativ bemerkbar machen. Das schließt nicht aus, dass bestimmte Organe oder Organsysteme eher oder sensibler reagieren, was auch für das Gehirn gelten könnte, das immerhin zu 85 bis 90% aus Wasser beseht. Damit ist der Wasseranteil des Gehirns ‑ verglichen mit allen anderen Organen, einschließlich der Nieren ‑ am höchsten. Auch individuelle Befindlichkeiten spielen mit hoher Sicherheit eine Rolle.
Eine Dehydrierung ist als (Mit-)Verursacherin von Affektstörungen vor allem dann nicht auszuschließen, wenn es sich um eine leichte und langfristige Unterversorgung handelt, bei der eine Person ständig zu wenig Flüssigkeit zu sich nimmt, aber noch keine eindeutigen oder sogar bedrohlichen Symptome spürt. Denn bei einer starken, oft kurzfristigen Dehydrierung kommt es zu massiven Symptomen bis zum Bewusstseinsverlust, und Stimmungsveränderungen spielen dann aus naheliegenden Gründen nur noch eine untergeordnete Rolle.
Ursachen und Definition eines Flüssigkeitsmangels
Die Gründe einer Dehydrierung sind relativ gut einzugrenzen:
- Generell bei einem zu geringen Trinkvolumen
- Geringes Trinkvolumen bei vermehrtem Schwitzen wegen Hitze, Anstrengung (Arbeit, Sport) oder Fieber
- Durstgefühl ist geringer als der Trinkbedarf, vor allem bei älteren Menschen ein Problem
- Nierenerkrankungen
- Diabetes insipidus centralis
- Schäden der Regelkreise des Wasserhaushalts im Gehirn, beispielsweise im Hypothalamus
- Diabetes mellitus
- Morbus Addison
- Infektionskrankheiten
- Verbrennungen
- Durchfall und Erbrechen
- Einnahme von Diuretika
- Einnahme bestimmter Drogen, zum Beispiel Ecstasy
Eine milde Form der Dehydrierung liegt vor, wenn der Wassergehalt des Körpers etwa 1,5% unter dem Normwert liegt. Ein Durstgefühl stellt sich bei einem Absinken des Wassergehaltes zwischen 1% und 2% ein, was darauf hindeutet, dass bei einem Teil der Menschen die Gefahr eines permanenten Wassermangels bestehen könnte.
Dieses Thema war Gegenstand einer US-amerikanischen Studie und leitet über zur Frage, ob wissenschaftliche Untersuchungen des Einflusses von Dehydrierung auf kognitive Fähigkeiten und Affekte zu weiteren Erkenntnissen geführt haben.
Die UConn-Studie über Zusammenhänge zwischen Dehydrierung und Stimmungslage
Leider sind Studien auf diesem Gebiet Mangelware. Im Gegensatz zu Mikronährstoffen oder Lipiden gibt es nur wenige Untersuchungen über die Auswirkungen des Flüssigkeitsmangels auf Stimmungslage oder den Zusammenhang mit einer Affektstörung.
Eine Studie, die Lawrence E. Armstrong und Harris Lieberman an der University of Connecticut (UConn)/USA durchführten, belegt den negativen Einfluss einer geringfügigen Dehydrierung auf kognitive Leistungen und die Stimmungslage. Dabei machte es keinen Unterschied, ob die Probanden sich 40 Minuten lang sportlich betätigten oder in der gleichen Zeit Ruhe bewahrten. Dazu der Studienleiter L. E. Armstrong: „Unser Durstgefühl stellt sich nicht ein, bevor wir zu ca. 1 bis 2 Prozent dehydriert sind. In diesem Zustand ist die Dehydrierung jedoch bereits manifest und beeinflusst Geist und Körper. Die Austrocknung betrifft alle Menschen und daher ist es wichtig für alle, darauf zu achten, egal ob sie als Angestellte am Computer arbeiten oder gerade Marathon laufen.“ (Quelle: UConn Today vom 21. Februar 2012. http://www. today.uconn.edu/... oder: http://www.ncbi.nlm.nih.gov/...).
Es nahmen 51 gesunde Personen an zwei Teilstudien teil (25 Frauen und 26 Männer zwischen 20 und 23 Jahren). Untersucht wurden Wachsamkeit, Reaktionszeit, Lern- und Konzentrationsfähigkeit, Gedächtnisleistungen, Urteilsvermögen und Stimmungslage.
Bei den Auswertungen stellte man Unterschiede zwischen den Geschlechtern fest. Während die Frauen bei einer leichten Dehydrierung eher zu Kopfschmerzen, Müdigkeit und Konzentrationsschwierigkeiten neigten und die gestellten Aufgaben von ihnen als schwieriger wahrgenommen wurden, gab es keinen signifikanten Rückgang kognitiver Fähigkeiten. Bei den Männern sah das Ergebnis anders aus. Sie hatten Gedächtnis- und Wachsamkeitsschwierigkeiten, erlebten aber auch Müdigkeit, Anspannung und Angst bzw. Unruhe. Negative Stimmungswechsel waren bei Frauen höher ausgeprägt als bei Männern.
Die Ursachen für die massiven Reaktionen auf eine leichte Dehydrierung sind unklar, die Forscher fordern hier mehr Untersuchungen. Andere Studien hatten gezeigt, dass einen Flüssigkeitsmangel erkennende Neurone Signale an andere Hirnregionen senden, die für die Stimmungsregulation zuständig sein sollen. Es könnte sich also um ein Warnsystem handeln, das bei Mangel das System „herunterfährt“, um Ressourcen zu sparen und einen weiteren Anreiz liefert, den Wassermangel schnellstmöglichst auszugleichen (Quelle: UConn Today, wie oben).
Sonstige Thesen über Zusammenhänge zwischen Dehydrierung und Affektveränderungen
Die Heilung-durch-Wasser-These des iranisch-amerikanischen Arztes Fereydoon Batmanghelidj postuliert, dass die Ursache u. a. einer Depression vor allem an einer oft nicht erkannten Dehydrierung oder der Verwendung ungeeigneter Getränke liegt. Inwiefern eine solche einseitige Sichtweise plausibel ist, wird Gegenstand der Erörterungen des Kapitels 6 über versorgungsorientierte Therapien sein.
Fazit: Flüssigkeitsmangel und Affektstörungen
Aufgrund der hohen Bedeutung des Wassers für alle physischen Basisfunktionen stellt auch Flüssigkeitsmangel eine potentielle Gefahr dar, seine Relevanz als Auslöser von Affektstörungen bleibt aber mit hoher Wahrscheinlichkeit eher gering.
Die Armstrong-Studie der UConn verweist auf ungünstige Veränderungen der Stimmungslage bei leichter Dehydrierung, allerdings handelt es sich bei den dort beschriebenen Symptomen um leichtere depressive Verstimmungen und keinesfalls um klinisch relevante Affektstörungen.
Aus den Studienergebnisse kann man jedoch den Schluss ziehen, dass auch ein leichter Wassermangel in der Lage ist, bei Vorliegen einer schon bestehenden, manifesten Affektstörung diese zu verstärken. Ebenfalls könnte sich eine prekäre Ausgangslage, bei der die Stimmung eines Patienten schon „auf der Kippe steht“, durch zusätzliche Dehydrierung überhaupt erst verschärfen und zu einer Depression führen. Vergleichbares gilt jedoch für sämtliche stoffwechselaktive Kausalfaktoren und Wasser hat hier als geringrelevanter Kausalfaktor keine Sonderstellung,
4.7 Schäden der ursprünglichen Erbinformation und Affektstörungen ▲
Die ursprüngliche Erbinformation hebt sich aufgrund ihres höheren Relevanzgrades von den bisher erörterten geringrelevanten Kausalfaktoren Aminosäuren, Mikronährstoffen, Fettsäuren bzw. Fettbegleitstoffen und Wasser klar ab. Daher ist sie für die Diskussion der Ursachen affektiver Erkrankungen wesentlich interessanter als diese.
Die ursprüngliche Erbinformation entsteht durch die Verschmelzung der beiden elterlichen Keimzellen zur ersten gemeinsamen Zelle eines neu entstehenden Organismus und besteht aus zahlreichen Bauanleitungen bzw. DNA‑Codes für Enzyme, Proteine und nicht‑codierende Ribonukleinsäuren. DNA‑Codes für Enzyme und Proteine werden als Gene bezeichnet, DNA‑Codes für nicht-codierende Ribonukleinsäuren als ncRNA‑Codes.
Mit der anschließenden ersten Teilung wandelt sich die ursprüngliche Erbinformation zur Zell-DNA, die in beiden Tochterzellen (und allen nachfolgenden Zellen) idealerweise in identischer Form vorliegen sollte. Zell-DNA dient der Proteinbiosynthese bzw. der Transkription als Matrize für die Herstellung von Peptiden und ncRNA-Molekülen und ist die Basis aller weiterer Zellteilungen, treibt die Entwicklung vom Keimling über den Embryo bis zum Fötus voran und stellt später die Grundlage zur Aufrechterhaltung sämtlicher Zellfunktionen im fertig entwickelten Organismus dar.
Die aktive Rolle der Erbinformation ist mit der Keimzellenverschmelzung und Zurverfügungstellung einer Blaupause für die DNA aller weiterer Zellen beendet. Das hier zugrundeliegende Zellmodell unterscheidet strikt zwischen nicht aktiver ursprünglicher Erbinformation als Kausalfaktor und aktiver Zell-DNA, die kein Kausalfaktor ist. Beide Substanzen repräsentieren im Zellmodell unterschiedliche Elemente mit unterschiedlichen Rollen im Zellgeschehen.
Die Problematik der ursprünglichen Erbinformation liegt hauptsächlich darin, Mutationen in den neu entstehenden Organismus einzuschleusen. In Abhängigkeit von Art und Höhe der Schäden resultieren daraus dann mehr oder weniger massive Fehler der Proteinbiosynthese, so dass es sowohl während der Embryogenese als auch später im fertig ausgebildeten Organismus zu mehr oder weniger massiven Zell‑ und Organstörungen kommen kann.
Erbinformationsschäden können generationenübergreifend innerhalb eines Familienverbandes durch die elterlichen Keimzellen weitergegeben werden oder auch spontan in Keimzellen bzw. ‑ eher selten ‑ während der Keimzellenverschmelzung entstehen.
Der Fokus des Abschnitts 4.7 liegt auf direkten Auswirkungen von Erbinformationsveränderungen auf das Zentralnervensystem bzw. das Gehirn, denn die Grundlage aller Überlegungen sind die kausaltheoretischen Begründungen Affektiver Störungen, so wie in Kapitel 1 beschrieben. Dass affektive Störungen ihren Ursprung auch in einer erblich bedingten Erkrankung peripherer Organe haben können, beispielsweise aufgrund erblich bedingter Schilddrüsenfehlfunktionen, soll hier aus systematischen Gründen nicht thematisiert werden. Erkrankungen peripherer Organe und deren Auswirkungen auf das Zentralnervensystem und Affektive Störungen werden im Teil B des vierten Kapitels noch ausführlich dargestellt (→ Kapitel 4 Teil B, ab Abschnitt 4.14)
4.7.1 Genetisch bedingte Erkrankungen bzw. Syndrome
Es werden drei verschiedene Arten von Erbinformationsschäden differenziert, aus denen drei verschiedene Erkrankungstypen bzw. Syndrome resultieren können:
- Genetische Erkrankungen im eigentlichen Sinne mit diagnostisch gut erfassbaren Merkmalen bzw. Symptomen, die beispielsweise auf einem einzigen pathologisch veränderten vererbaren Peptid-Code (Gen) beruhen.
- Syndrome aufgrund von Veränderungen der Chromosomenanzahl oder größerer Chromosomenstrukturen.
- Bei Erkrankungen mit polygenetischer Prädisposition gelten multiple Genveränderungen lediglich als Mitverursacher. Die Krankheiten entstehen nur zusammen mit weiteren negativen Einflüssen bzw. Noxen.
Im (multi-)kausalen Modell werden Veränderungen sowohl von Genen als auch von ncRNA-Codes diskutiert, insbesondere bei den Erkrankungsformen 1 und 3 oben. Leider liegt der Fokus in der Forschung ausschließlich auf Genveränderungen, da genregulative ncRNA-Moleküle erst vor wenigen Jahren entdeckt wurden und deren Funktionen noch als unklar gelten (→ Abschnitt 4.10).
Kategorie 1: Genetisch bedingte Erkrankungen im eigentlichen Sinne
Da vererbbare genetisch bedingte Erkrankungen im engeren Sinne in der Regel auf einem einzigen fehlerhaften Gen beruhen, gelten sie als „monogenetisch bedingt“. Es werden autosomale und gonosomale Mutationen unterschieden, letztere sind auf den Geschlechtschromosomen (Gonosomen) lokalisiert.
Dass in Wissenschaft, Forschung und Lehre ausschließlich Genveränderungen als Ursachen monogenetischer Erbkrankheiten untersucht und interpretiert werden, ist spätestens seit der Entdeckung kurzkettiger genregulierender ncRNA-Moleküle diskussionsbedürftig, denn prinzipiell können erblich bedingte ncRNA-Codeveränderungen zu vergleichbaren Erkrankungen führen. Dies gilt insbesondere für ncRNA-Moleküle mit erheblichem genregulativen Einfluss (→ Abschnitt 4.10). In dieser Publikation gelten daher im Gegensatz zur herkömmlichen Sichtweise auch erbliche Veränderungen von ncRNA-Codes als potentielle Ursachen genetisch bedinger Erkrankungen.
Erkrankungen dieses Typs folgen fast immer einem regelmäßigen Erbgang, das heißt sie sind seit mehreren Generationen in einem bestimmten familiären Umfeld nachweisbar. Das gilt beispielsweise für bestimmte Bluterkrankheiten (Hämophilie Typ A oder Typ B). In der russischen Zarenfamilie trat Hämophilie über Jahrhunderte auf. Weitere Beispiele sind Mukoviszidose, Albinismus, Sichelzellenanämie, Phenylketonurie, Chorea Huntington oder Muskeldystrophie. Vergleichbares gilt auch für Mutationen wichtiger ncRNA‑Codes der ursprünglichen Erbinformation.
Derartige Veränderungen können auch das Ergebnis spontaner Neumutationen elterlicher Keimzellen sein und werden dann nicht mehr den erblichen Mutationen im engeren Sinne zugeordnet. In den hier genannten Zusammenhängen ist eine Differenzierung jedoch nicht sinnvoll, da beide Varianten die ursprüngliche Erbinformation vom Prinzip her auf die gleiche Weise verändern.
Theoretisch können Mutationen auch während des Vorgangs der Verschmelzung beider Keimzellen spontan entstehen. Ein solcher sehr seltener (Sonder‑)Fall gehört im hier zugrund liegendZellmodell ebenfalls zur Kategorie 1.
Mögliche Konsequenzen fehlerhafter Peptid‑Codes sind der Totalausfall oder die Fehlbildung betroffener Enzyme oder Proteine. Handelt es sich um ein für wichtige Stoffwechselprozesse zuständiges sogenanntes „Schlüsselpeptid“, sind diese Abläufe entsprechend massiv gestört. Dabei spielt auch die Art der Code‑Veränderung eine Rolle. Bestimmte monogenetische Erkrankungen können zahlreiche Ausprägungen haben ‑ je nachdem, auf welche Weise der Code eine bestimmten Peptids verändert wurde.
Die Folgen fehlerhafter ncRNA‑Codes können ein Totalausfall oder Störungen genregulativer Prozesse sein, an denen die betroffenen ncRNA‑Moleküle beteiligt sind. In der Konsequenz bedeutet das ebenfalls ein Totalausfall oder eine verminderte bzw. veränderte Synthese betroffener Enzyme oder Proteine und kann bei wichtigen Substanzen entsprechend massiv gestörte Abläufe zur Folge haben.
Es ist eindeutig auszuschließen, dass Affekterkrankungen auf Veränderungen einzelner Gene beruhen:
- Monogenetische Störungen der Kategorie 1 kommen nicht als Ursachen einer Depression, Manie oder Bipolaren Störung infrage. Das wurde durch jahrzehntelange Forschungen mit Hilfe von Familien- und Zwillingsstudien bestätigt.
- Nichtsdestotrotz treten bei einigen monogenetisch bedingten Erkrankungen Affektstörungen als Begleitsymptome auf.
Die Frage, ob Schädigungen einzelner ncRNA-Codes die Entstehung einer Affekterkrankung verursachen oder fördern können, wurde noch nicht untersucht; mit einer gewissen Wahrscheinlichkeit sind die gleichen Resultate zu erwarten wie bei Genen.
Kategorie 2: Syndrome nach chromosomalen Schäden
Als Genomfehler oder Genomschäden werden Abweichungen von Chromosomenanzahl und/oder der Chromosomenstruktur bezeichnet. Bei autosomalen Genomfehlern liegen Veränderungen an den Autosomen vor, bei gonosomalen Genomschäden an den Geschlechtschromosomen (Gonosomen). Es handelt sich meist um spontane Defekte elterlicher Keimzellen, die vor oder während der Keimzellenverschmelzung entstehen und nicht vererbt werden. Die Ursachen solcher Defekte sind meist unklar. Bei vielen chromosomalen Schädigungen kommt es nicht zur Ausbildung eines lebensfähigen Embryos oder zum vorzeitigen Schwangerschaftsabbruch.
Genomdefekte können auch später im Laufe erster Zellteilungen auftreten, so dass im vollständigen Organismus nicht alle Zellen des Körpers die Genomanomalie aufweisen. Auch hier sind die Ursachen meist unbekannt. Es handelt sich um Grenzfälle, die im Zellmodell ebenfalls zur Kategorie 2 zählen.
Die mit chromosomalen Schäden einhergehenden Beeinträchtigungen galten früher als Krankheiten, heutzutage hat sich der Syndrom-Begriff durchgesetzt. Das liegt nicht nur an der Symptomfülle, die mit chromosomalen Schäden einhergehen. Der Begriff soll auch helfen, Diskriminierungen zu vermeiden, die mit dem Wort „Erkrankung“ verbunden sein sollen.
Beispiele sind verschiedene Trisomie-Syndrome, die mit geistigen und oftmals schweren körperlichen Behinderungen einhergehen, und bei denen ein bestimmtes autosomes Chromosom dreimal ‑ statt zweimal ‑ vorhanden ist: Trisomie 13, 18, 21 oder 22. Trisomie 21 ist die bekannteste Form und wird auch als Down‑Syndrom bezeichnet.
Das Klinefelter‑Syndrom ist ein Beispiel für eine gonosomale Chromosomenabweichung und betrifft ausschließlich Männer, die ein zusätzliches X‑Geschlechtschromosom aufweisen. Die Konsequenzen sind Testosteronmangel und unterentwickelte Keimdrüsen, manchmal auch ein eher weiblicher Körperbau oder leichte sprachliche bzw. autistische Störungen.
Chromosomale Schädigungen scheiden ebenfalls als Verursacher eigenständiger primärer Affektstörungen aus. Nichtsdestotrotz treten bei vielen chromosomal bedingten Syndromen Affektive Erkrankungen als Begleitsymptome auf, so beispielsweise auch beim Klinefelter-Syndrom, die hier als sekundäre Affektstörungen bezeichnet werden
Kategorie 3: Erkrankungen mit polygenetischer Prädisposition
Bei Erkrankungen mit polygenetischer Prädisposition besteht lediglich ein statistischer Zusammenhang zwischen bestimmten Genveränderungen und einer Erkrankung. Polygenetische Veränderungen haben daher weder zwangsläufig eine Krankheit zur Folge noch weisen sie einen regelmäßigen Erbgang auf.
Es gibt ein quantifizierbares Wiederholungsrisiko der Erkrankung innerhalb einer Bevölkerung, Bevölkerungsgruppe oder innerhalb bestimmter Verwandtschaftsgrade. Somit handelt es sich bei einer polygenetischen Prädisposition um eine statistisch belegte Wahrscheinlichkeit.
Mittels Familien- und Zwillingsforschung wird untersucht, ob Erkrankungen polygenetische Ursachenkomponenten haben bzw. wie hoch diese sind. Eine Schwierigkeit dabei ist es, erworbene Dispositionen von genetischen Dispositionen zu unterscheiden. So kann es innerhalb einer Familie zu Krankheitshäufungen auch aufgrund gleicher Lebensweisen, Erziehungsmethoden oder Erfahrungen kommen, ohne dass genetische Faktoren eine Rolle spielen oder sie nur von untergeordneter Bedeutung sind.
Mit Hilfe von Adoptionsstudien, insbesondere mit eineiigen Zwillingen, versucht man, beide Haupteinflüsse ‑ genetisch mitbedingt und/oder durch Lebensumstände mitbedingt ‑ voneinander abzugrenzen.
Es wird schon seit Anfang des 20. Jahrhunderts versucht, familiäre bzw. bevölkerungsspezifische Dispositionen bei verschiedenen Erkrankungen experimentell zu klären.
Kriterien einer polygenetischen Prädisposition sind...
- ein auffällig gehäuftes Auftreten der Erkrankung in einer abgrenzbaren Bevölkerungsgruppe (Volk, Nation/Staat/Land/Region, Sippe/Familie) ohne nachweisbaren Erbgang,
- eine bestimmte, meist konstante Anzahl Betroffener in dieser Bevölkerungsgruppe,
- auffällige Verwandtschaftsgrade zwischen Erkrankten und
- ein früher individueller Zeitpunkt des Auftretens der Erkrankung (der polygenetische bzw. bevölkerungsspezifische Einfluss ist um so höher, je früher jemand erkrankt oder das Merkmal sichtbar wird).
Durch Fortschritte in Medizin und Genetik sind seit relativ kurzer Zeit auch nachweisbare Genauffälligkeiten unter Erkrankten ein Kriterium zur Feststellung polygenetischer Prädispositionen. Dazu werden die Genabfolgen auf Gemeinsamkeiten analysiert, was erst seit kurzer Zeit technisch überhaupt möglich ist. Der Verdacht eines Zusammenhangs betrifft Genauffälligkeiten, die alle Erkrankten aufweisen.
Aus technischen Gründen kann nur eine begrenzte Anzahl sogenannter Dispositionsgene untersucht werden, bei denen ein Zusammenhang mit der Erkrankung von vornherein vermutet wird.
Die Beschränkung auf Dispositionsgene mit hohem Spekulationsfaktor mindert allerdings den Aussagewert der Ergebnisse, denn wer kann schon wissen, ob es unter den vielen nicht berücksichtigten Genen welche gibt, die an der Merkmalsübertragung ebenfalls beteiligt sind oder deren Beteiligung vielleicht sogar wesentlich relevanter ist? Auch ist es nicht möglich, Kausalzusammenhänge zwischen Dispositionsgenen und Erkrankung nachzuweisen.
Auch bei polygenetischen Prädispositionen werden ‑ wie immer ‑ fast ausschließlich Peptidveränderungen als Ursachen in Betracht gezogen. Die gleichfalls wichtigen (oder noch wichtigeren?) ncRNA‑Codes fallen unter den Tisch. In dieser Publikation werden auch die Möglichkeiten multipler ncRNA-Veränderungen als Ursachen von Erkrankungen diskutiert, die mit polygenetisch bedingten vergleichbar sind.
Polygenetische Genveränderungen gelten als potentielle Mitverursacher Affektiver Störungen, zumindest wurden entsprechende Zusammenhänge in vielen Untersuchungen bestätigt. Auch hier gilt, dass damit Kausalzusammenhänge nicht bewiesen sind, es kann sich auch um Korrelationen handeln. Aus den oben genannten Gründen ist auch hier die Schlussfolgerung zulässig, dass dies ebenfalls für multiple ncRNA-Veränderungen gelten muss.
4.7.2 Erbinformation und Affektstörungen aus (multi-)kausaler Sicht
Zusammenhänge zwischen der ursprünglichen Erbinformation und der Entstehung Affektiver Störungen werden in den folgenden Abschnitten unter zwei Aspekten diskutiert:
- Sekundäre Affektstörungen als Neben- bzw. Begleitsymptomatik genetischer Störungen, haupsächlich anhand des Klinefelter‑Syndroms (→ Abschnitt 4.7.3).
- Die Verantwortung polygenetischer Prädispositionen oder einer Kombination von ncRNA‑Codeveränderungen für die Entstehung primärer Affektstörungen anhand der kausaltheoretischen Modelle (→ Abschnitte 4.7.4 f.) und empirisch durch die Interpretation verschiedener Forschungsergebnisse (→ Abschnitt 4.7.6).
4.7.3 Affekterkrankungen als Nebensymptomatik genetischer Defekte (Sekundäre Affektstörungen)
Zusammenhänge zwischen dem Klinefelter-Syndrom und sekundären affektiven Erkrankungen
Das Klinefelter‑Syndrom beruht auf einer Geschlechtschromosomenabweichung bei Männern. Es ist durch ein zusätzliches X‑Geschlechtschromosom charakterisiert ‑ also einen XXY-Satz statt des üblichen männlichen XY‑Paars.
Die charakteristischen Hauptsymptome bzw. Primärsymptome des Klinefelter-Syndroms sind unterentwickelte Keimdrüsen und ein Mangel am männlichen Geschlechtshormon Testosteron, woraus Azoospermie und Unfruchtbarkeit als weitere charakterische Folgesymptome resultieren. Als charakteristisch werden Symptome bezeichnet, die immer auftreten und kausal mit dem Merkmal (hier: XXY-Gonosomen) in einem Zusammenhang stehen.
Das Klinefelter‑Syndrom eignet sich zur Erörterung multikausaler Zusammenhänge, da mit 70%iger Wahrscheinlichkeit Affektstörungen als uncharakteristische Begleitsymptome bzw. Sekundärsymptome auftreten, meist in Form der Depression. Begleitende affektive Erkrankungen werden als sekundäre Affektstörungen bezeichnet. Uncharakteristisch sind Symptome, die nur bei einem Teil der Betroffenen auftreten. Es müssen also noch andere Ursachen als die genetischen eine Rolle spielen. Mit 70% ist die Quote für ein uncharakteristisches Begleitsymptom allerdings außerordentlich hoch (Quelle: Auer M., Fuss J., Psychische Aspekte des Klinefelter‑Syndroms, Deutsche Klinefelter‑Syndrom Vereinigung e. V., München/Mannheim 2013).
Syndrombezeichung, XXY‑Gonsomenabweichung als Merkmal bzw. Primärauslöser und die diversen Symptome sind strikt zu unterscheiden, ansonsten sind Missverständnisse und Verwirrung die Folgen. Leider werden die Begriffe häufig nicht korrekt verwendet: Nicht das Klinefelter‑Syndrom ist die Ursache diverser Symptome, sondern die XXY‑Anomalie löst verschiedenartige charakteristische und ggf. uncharakteristische Symptome aus. Und alle zusammen ‑ also Primärauslöser und die darauf beruhenden Primär‑ und Sekundärsymptome ‑ repräsentieren das, was im medizinischen Sinne unter dem Klinefelter‑Syndrom verstanden wird.
Leider wird der Gendefekt und damit das Klinefelter-Syndrom häufig erst diagnostiziert, wenn ein schon erwachsener Patient wegen Antriebsarmut oder Stimmungsschwankungen ärztlichen Rat einholt. Meist bleibt die genetische Ursache aufgrund einer ungenügenden Differentialdiagnostik unerkannt, und es wird fälschlicherweise eine Depression oder Bipolare Störung als Primärerkrankung diagnostiziert. Die Konsequenzen für Betroffene: langfristig ineffiziente oder sogar ineffektive Behandlungen ohne oder mit maximal mäßigem Erfolg.
Uncharakteristische Begleitsymptome verschwinden zu einem großen Teil nach einer erfolgreichen Behandlung der Hauptsymptome, beim Klinefelter‑Syndrom in der Regel nach einer Hormonersatztherapie.
Manchmal erweist sich die Depression jedoch als wesentlich hartnäckiger als die Hauptsymptomatik und bleibt trotz einer ansonsten erfolgreichen Behandlung der Hauptsymptome bestehen (Quelle: Auer M., Fuss J., Psychische Aspekte des Klinefelter‑Syndroms, Deutsche Klinefelter‑Syndrom Vereinigung e. V., München/Mannheim 2013, https://studylibde.com/doc/1432169...).
Für dieses Phänomen gibt es keine einfache Erklärungen, vielmehr kommen verschiedene Ursache-Wirkungs-Szenarien infrage. Abbildung 26 gibt einen Überblick über die komplexe Fragestellung. Die Depression taucht dort an neun Stellen auf.
Affekterkrankungen bei Klinefelter-Patienten ohne XXY-Zusammenhang
Ein Klinefelter-Betroffener kann vollkommen syndromunabhängig an einer Affektstörung erkranken. Sie wäre dann entweder eine eigenständige Primärerkrankung oder die sekundäre Begleitsymptomatik einer anderen Primärerkrankung bzw. eines anderen Syndroms (→ Abbildung 26 links oben).
Die Möglichkeit einer XXY-unabhängigen Affektstörung ist diagnostisch immer in Betracht zu ziehen. Eine Depression bei Klinefelter-Patienten reflexartig sofort mit dem Syndrom in Verbindung zu bringen, ist fahrlässig.
Affekterkrankungen bei Klinefelter-Patienten mit XXY-Zusammenhang
Acht verschiedene Szenarien kommen für einen (multi‑)kausalen Zusammenhang einer Depression mit der XXY‑Abweichung bzw. den damit verbundenen Symptomen infrage (→ Abbildung 26a). Wichtig: Hier sind keine depressiven Verstimmungen gemeint, diese können allerdings zusätzlich auftreten.
Es werden fünf Ursache‑Wirkungs‑Muster unterschieden, die sowohl einzeln als auch in Kombination bei Klinefelter‑Patienten eine Rolle spielen können, was Diagnose oder Therapie erheblich verkompliziert:
- Kausalitätsmuster KDI
Beim Typ KDI liegt ein direkter Kausalzusammenhang zwischen dem charakteristischen Hauptsymptom des Testosteronmangels und der uncharakteristischen Nebensymptomatik der Affektstörung vor. Der hormonelle Mangel führt unmittelbar zu funktionalen Reizverarbeitungsstörungen in affektrelevanten Hirnarealen, allerdings ist zu beachten, dass hierfür weitere Noxen bzw. negative Einflüsse vonnöten sind, damit sich uncharakteristische Symptome überhaupt entwickeln.
Mit großer Wahrscheinlichkeit setzt diese Entwicklung mit dem Beginn der Pubertät ein, da in dieser Zeit im Normalfall der Testosteronspiegel bei Jungen steigt und im Gehirn affektrelevante Areale funktional beeinflusst. Mit einer individuell angepassten Hormonersatztherapie bestünde schon zu diesem frühen Zeitpunkt die Möglichkeit, zielgerichtet beide Symptomatiken zu behandeln.
- Kausalitäsmuster KIN-1
Auch beim KIN-1-Muster liegt ein eindeutiger Kausalzusammenhang in Bezug auf den Hormonmangel vor, allerdings indirekt und ausgelöst durch testosteronmangelbedingte strukturelle Entwicklungsstörungen in affektrelevanten Hirnarealen. Der Hormonmangel kann nämlich mittel- bis langfristig über funktionale Störungen hinaus auch zu einem „Rückbau“ bzw. einer sonstigen strukturellen Fehlentwicklung im Gehirn führen (→ 3‑Stufen‑Modell in Kapitel 1). Testosteron ist am Umbau der Gehirnstruktur während der Adoleszenz maßgeblich beteiligt.
Bei diesem Kausalitätsmuster besteht die Gefahr, dass sich die begleitende Depression zu einer eigenständigen Erkrankung entwickelt. Bei entsprechend starken strukturellen Veränderungen besteht die Gefahr, dass eine ausschließlich auf Hormonersatz basierende Therapie keine Wirkung mehr auf die affektive Sekundärsymptomatik hätte, da sie die ungünstige strukturelle Hirnentwicklung nicht mehr verändern kann.
Auch hier gilt: Zusätzlich zu den genannten Einflüssen durch Hormonmangel und Strukturveränderungen sind weitere Noxen notwendig, damit sich Affektive Störungen ausprägen können.
- Kausalitätsmuster KIN-2
Wie beim Kausalmuster KIN-1 führt der XXY‑bedingte Testosteronmangel zu Gehirnstrukturveränderungen, die jedoch andere Hirnareale als die affektrelevanten betreffen. Die Veränderungen haben in diesen Fällen auch andere Folgen, beispielsweise motorische Störungen und/oder einen geringradigen Autismus bzw. ein Asperger‑Syndrom. Es kommt aufgrund dieser Symptome langfristig zu psychischem Disstress, denn Scham, Minderwertigkeitsgefühle, depressive Verstimmungen und/oder ein gesellschaftlicher Rückzug sind mögliche Folgen.
Die durch Disstress ausgelöste chronisch hohe Ausschüttung des Stresshormons Cortisol kann wiederum zu funktionalen Störungen und/oder strukturellen Schädigungen affektrelevanter Hirnareale führen*. Auch besteht die Möglichkeit, dass der langfristige Stress weitere hirnschädigende Mechanismen in Gang setzt. Zusammen mit weiteren syndromunabhängigen Noxen kann dies zu einer Affektstörung führen.
Auch hier kann sich die begleitende Affektstörung chronifizieren und zu einer eigenständigen Erkrankung entwickeln, die von einedie Klinefelter-Therapie, beispielsweise durch Hormonsubstitution, nicht oder nur unzureichend profitiert.
*) Die Mechanismen von Stressbelastung und Affektstörung werden im Abschnitt 4.12 im Detail erörtert.
- Kausalitätsmuster REA
Der Klinefelter-Patient reagiert aufgrund der charakteristischen Haupt- und Folgesymptome direkt mit (negativem) Disstress aufgrund von Scham, Unzufriedenheit, depressiver Verstimmung oder Minderwertigkeitskomplexen. Es bedarf hier nicht dem „Umweg“ über testosteronmangelbedingte funktionale oder strukturelle Hirnveränderungen.
Genügend hoher Disstress führt langfristig zu einem erhöhten Cortisolspiegel, dessen nervenschädigendes Potential wiederum zusammen mit weiteren Einflussfaktoren eine Depression triggern kann*.
Auch hier kann sich die begleitende Affektstörung chronifizieren und zu einer eigenständigen Erkrankung entwickeln, die von einedie Klinefelter-Therapie, beispielsweise durch Hormonsubstitution, nicht oder nur unzureichend profitiert.
*) Die Mechanismen von Stressbelastung, Cortisol und Affektstörungen werden im Abschnitt 4.12 erörtert.
- Korrelationsmuster KOR
Die Affektstörung kann ebenfalls auf einem direkten XXY‑Zusammenhang basieren, aber ohne direkten oder indirekten Bezug zu charakteristischen Klinefelter‑Symptomen: Das XXY‑Genom hätte dann sowohl Klinefelter‑typische Symptome als auch unabhängig davon psychiatrische Symptome zur Folge.
Damit besteht die Möglichkeit eines korrelativen Zusammenhangs zwischen Affektiven Störungen und Klinefelter-Symptomen.
Die diesem Szenario zugrundeliegenden Prozesse, die über die XXY-Abweichung direkt zu affektiven Störungen führen, sind unbekannt. Damit sich eine Affekterkrankung ausprägt, sind auch hier weitere Einflüsse notwendig, die XXY-Problematik alleine reicht nicht aus.
ABBILDUNGEN 26 A/B: KLINEFELTER‑SYNDROM UND (KLINISCHE) DEPRESSION IM ÜBERBLICK

Abbildungen 26a und 26b: Die Abbildung 26a zeigt auf einen Blick, wie komplex die Beziehungen zwischen Affektstörungen (Depression) und Klinefelter‑Syndrom sind. Eine Depression tritt beim Klinefelter‑Syndrom mit einer Wahrscheinlichkeit von 70% auf, ist aber nicht zwangsläufig. Sie wird daher als uncharakteristisches Begleitsymptom bezeichnet und kann ‑ zusammen mit weiteren Ursachen ‑ auf den vom Primärauslöser (XXY‑Genom) hervorgerufenen charakteristischen Hauptsymptomen des Klinefelter‑Syndroms beruhen. Der XXY‑Genomdefekt kann aber auch ohne Zusammenhang mit charakteristischen Klinefelter‑Symptomen für eine Depression direkt oder indirekt verantwortlich sein, aber auch hier nur zusammen mit weiteren Ursachen. Ebenso muss in Erwägung gezogen werden, dass eine Affektstörung überhaupt keinen Zusammenhang mit der XXY‑Genomabbweichung hat. Zwischen den Hauptsymptomen (Keimdrüsenunterentwicklung und Testosteronmangel) ist der Kausalzusammenhang unklar, denn der Testosteronmangel kann sowohl auf unterentwickelten Keimdrüsen beruhen als auch umgekehrt. Neben einer Depression kann es auch zu depressiven Verstimmungen kommen, die in diesem Modell nicht berücksichtigt wurden.
Weitere genetisch bedingte Erkrankungen mit begleitenden (sekundären) Affektstörungen
Definitionen von Kausalitäten bzw. Korrelationen zwischen dem Klinefelter-Syndrom und sekundären Affektstörungen eignen sich prinzipiell ebenfalls für Beschreibungen von Ursache-Wirkungs-Mustern affektiver Begleiterkrankungen bei anderen genetischen Erkrankungen bzw. Syndromen, wenngleich es im Einzelfall Abweichungen geben dürfte.
Bestimmte genetische Erkrankungen könnten ebenfalls uncharakteristische begleitende Affektstörungen durch massiven negativen Stress und lebenslange Einschränkungen an Lebensqualität, Scham, Ausgrenzung und/oder sozialer Isolierung provozieren. Ebenfalls sind korrelative Zusammenhänge denkbar, bei denen die Codedefekte ‑ immer zusammen mit anderen Noxen ‑ direkt zentralnervöse Reizverarbeitungsstörungen zur Folge haben. Auch hier sind Affektstörungen aufgrund völlig anderer Ursachen denkbar.
Das Thema soll aus Platzgründen aber nicht ausführlicher dargestellt werden. Hier eine Auswahl von Erkrankungen, die auf Gendefekten beruhen und bei denen ähnliche Zusammenhänge mit begleitenden Affekterkrankungen wahrscheinlich sind, insbesondere durch erheblichen Stress:
- Achondroplasie
Diese Form des Zwergwuchses mit stark verkürzten Extremitäten bedeutet für Betroffene, gesellschaftlich erheblich ausgegrenzt zu werden.
- Albinismus
Neben einem auffälligen Erscheinungsbild durch fehlende Pigmentierung besteht eine Sehbehinderung. Besonders in afrikanischen Ländern werden vom Albinismus betroffene Menschen ausgegrenzt und sogar mit dem Tode bedroht, so dass eine Vielzahl von Stressfaktoren die Erkrankung begleiten.
- Apert-Syndrom
Hauptsymptome sind Verwachsungen im Bereich des Kopfes und der Extremitäten sowie erhebliche Fehlentwicklungen des Bewegungsapparates.
- Brachydaktylie und Polyaktylie
Hier handelt es sich um Fehlbildungen der oberen (Hände) und unteren Extremitäten (Füße).
- Engelmann-Ribbing-Syndrom
Bei Betroffenen ist der Bewegungsapparat erheblich eingeschränkt.
- Lippen-Kiefer-Gaumenspalte (LKGS)
Trotz therapeutischer Fortschritte ist die LKGS immer noch mit starken Beeinträchtigungen und Ausgrenzung verbunden. Die langwierige Behandlung kann sich bis ins Erwachsenenalter erstrecken, jedoch ist diese alternativlos, sowohl für die Beseitigung funktioneller Einschränkungen als auch für die Herstellung eines gesellschaftlich akzeptierten Erscheinungsbildes. Vor allem in Ländern der dritten Welt werden Patienten nicht adäquat behandelt mit lebenslangen Folgen.
Es ist noch nicht geklärt, ob es sich bei der LKGS um eine echte Erberkrankung handelt. Es gibt Anzeichen eines regelmäßigen Erbgangs, jedoch werden dessen Mechanismen noch nicht vollständig verstanden.
Bei den nachfolgend aufgezählten Erkrankungen könnten sämtliche Kausalmuster relevant sein, die schon beim Klinefelter-Syndrom plausibel waren:
- Charcot-Marie-Tooth-Hoffmann-Syndrom (CMT)
Die CMT-Erkrankung betrifft das periphere Nervensystem und führt langfristig zu einem Rückgang der Muskulatur dort, wo die geschädigten Nerven die Hirnsignale nicht mehr weiterleiten. Auch Neuropathien können auftreten. In vielen Fällen ist der Patient bei fortgeschrittener Erkrankung auf den Rollstuhl angewiesen. Die Erkrankung betrifft nach dem derzeitigen Wissensstand die peripheren Gliazellen (Myelinzellen) und nicht die des Gehirns oder Rückenmarks, letzeres würde eine Erkrankung an Multipler Sklerose bedeuten. Mit CMT könnten dennoch nicht entdeckte Beeinträchtigungen des Zentralnervensystems verbunden sein, denn der Aufbau der Gliazellen des Zentralnervensystems ähnelt dem der Gliazellen des peripheren Nervensystems.
- Chorea Huntington
Im Gegensatz zum Klinefelter‑Syndrom ist Chorea Huntington, veraltet auch als Veitstanz bezeichnet, eine erbliche Erkrankung, die ausschließlich das Gehirn betrifft und zu Beginn im Bereich der Stamm‑ bzw. Basalganglien mit degenerativen Prozessen verbunden ist. Im Endstadium weitet sich die Degeneration auf das gesamte Gehirn aus, führt zu Demenzsymptomen und zum Tode. Zunächst besteht auch hier die Möglichkeit einer Depression unabhängig von der Chorea‑Huntington‑Symptomatik.
Da Stammganglien sowohl an der Bewegungssteuerung und Motorik als auch an emotionalen Vorgängen mitwirken, kommt es potentiell in beiden Bereichen zu Ausfällen. Die hauptsächlich betroffenen Areale der Stammganglien sind der Nucleus caudatus und das Corpus striatum, die zentral an der Grobsteuerung von Bewegungsapparat und der Affektverarbeitung beteiligt sind, jedoch ist das Verständnis der Stammganglienfunktionen noch sehr bescheiden.
Trotz der ätiologischen Unterschiede der Erkrankungen sind die Kausalmuster Affektiver Störungen bei Chorea Huntington und dem Klinefelter‑Syndrom ähnlich (→ Abbildung 26 und entsprechende Erklärungen). Der zugrundeliegende Gendefekt führt entweder direkt zu funktionalen und/oder strukturellen Veränderungen affektrelevanter Hirnbereiche, und/oder die Erkrankung belastet Betroffene durch reaktiven Stress aufgrund der massiven Symptome, die mit Scham, langfristiger Frustration, Ausgrenzung und sozialem Rückzug verbunden sein können.
- Ehlers-Danlos-Syndrom
Ein durch Gendefekt erkranktes Bindegewebe führt zu vielerlei Symptomen und einer Verschlechterung der Lebensqualität durch Bewegungseinschränkungen und Schmerzen. Funktionelle oder strukturelle Schäden im Zentralnervensystem sind (noch) nicht nachgewiesen, jedoch denkbar, denn auch dort sind Bindegewebezellen wichtig. In diesem Falle könnten Affektstörungen die Folgen sein.
- Erblich bedingte polyzystische Nierenerkrankung
Dass Menschen mit einer chronischen Nierenerkrankung häufiger an einer Affektstörung erkranken, wurde durch Befragungsstudien bestätigt. Ein genauer Kausalzusammenhang ist auch hier nicht abzuleiten.
Zunächst stellt alleine die Kenntnis, mit Zystennieren leben zu müssen, eine hohe Stressbelastung dar ‑ auch wenn es noch gar nicht zu körperlichen Einschränkungen gekommen ist, und sich der Patient im symptomlosen Anfangsstadium der Erkrankung befindet. Dieser Stress kann mittel bis langfristig mitentscheidend sein für eine sich manifestierende Depression. Eine Beeinträchtigung des Nervensystems aufgrund sich langfristig verschlechternder Blutqualität durch ein kontinuierliches Sinken der Nierenleistung kann sowohl physiologisch zu Störungen der Reizverarbeitung im Gehirn und damit auch einer Affektstörung führen als auch zusätzlichen reaktiven Stress auslösen. Auch eine nierenerkrankungsbedingt nachlassende Nebennierenfunktion könnte eine Rolle spielen. Ebenfalls könnte sich eine Affektstörung unabhängig von der Zystennierenproblematik entwickeln oder der Gendefekt unmittelbar zu ungünstigen Veränderungen affektrelevanter Hirnareale führen.
Primäre Affekterkrankungen und multiple Gen- und ncRNA-Erbgutveränderungen
Dass die Genese primärer Affektstörungen durch eine Kombination polygenetischer Prädispositionen begünstigt wird, ist zentraler Bestandteil der Theorie der multifaktoriellen Ätiopathogenese (→ Kapitel 1) und wurde empirisch nachgewiesen.
Auch kausaltheoretisch wird von einer Beteiligung erblicher Faktoren an der Entstehung primärer Affekterkrankungen ausgegangen, schließlich hat die ursprüngliche Erbinformation einen Einfluss als wichtiger Kausalfaktor. Kausaltheoretisch werden aber nicht nur multiple Genveränderungen, d. h. Peptid‑Codeveränderungen, als potentielle Ursachen affektiver Erkrankungen diskutiert, es kommen auch multiple ncRNA‑Codeveränderungen als Mitverursacher einer Erkrankung infrage.
Dass nun auch ncRNA-Moleküle in die Diskussion einbezogen werden, ist aber nicht der einzige Unterschied zwischen kausaltheoretischem und klassischem Erklärungsansatz. Mit Hilfe der kausaltheoretischen Modelle können nämlich auch Zusammenhänge zwischen verschiedenen multiplen Erbinformationsveränderungen und Affekterkrankungen begründet werden:
- Kausaltheoretisch ist erklärbar, auf welche grundsätzlichen Weisen polygenetische Prädispositionen zur Entstehung affektiver Erkrankungen führen können.
- Kausaltheoretisch ist begründbar, warum multiple erbliche Einflüsse über polygenetische Prädispositionen hinaus existieren, insbesondere durch multiple normabweichende ncRNA‑Codes.
Zunächst stehen im nächsten Abschnitt die Vorgänge auf der zellulären Mikroebene im Vordergrund. Im darauffolgenden Abschnitt 4.7.5 werden durch Forschungen belegte Auswirkungen polygenetischer Prädispositionen auf Gewebe- und Hirnstrukturen und davon beeinflusste körperliche oder charakterliche Merkmale thematisiert. Dies hilft dabei, im zweiten Schritt potentielle polygenetische Einflüsse und solche multipler ncRNA-Codeveränderungen auf die hirnorganische Makroebene und deren Konsequenzen für Affekte und Affekterkrankungen besser zu verstehen, denn es gibt leider (noch) keine Forschungsarbeiten, die Zusammenhänge zwischen Erbinformationsveränderungen und Affektiven Störungen direkt untersuchen.
4.7.4 Auswirkungen multipler Mutationen auf Prozesse, Strukturen, Affekte und Affekterkrankungen
Es gibt viele Paralellen bezüglich ihrer direkten Auswirkungen auf Zellprozesse und formale Übereinstimmungen zwischen somatischen DNA‑Mutationen und Mutationen der ursprünglichen Erbinformation, denn beide betreffen prinzipiell die gleichen Zellstrukturen. Somatische DNA‑Mutationen und Zusammenhäge mit Affekten und affektiven Erkrankungen wurden schon weiter oben im Abschnitt 4.2 ausführlich diskutiert. Die dortigen Abbildungen 23, 24 und 25 ihrer prozessualen Konsequenzen sind aufgrund dieser Vergleichbarkeit auch auf Erbinfomationsveränderungen übertragbar. Zwei entscheidende Unterschiede gibt es:
- Mutationen der ursprünglichen Erbinformation werden auf sämtliche Zellen des entstehenden Organismus übertragen. Somatische Mutationen betreffen dagegen zunächst nur einzelne Zellen und werden ‑ falls die Zellen nicht durch Apoptose beseitigt werden oder Nekrose verschwinden ‑ auf deren Tochterzellen übertragen.
- Mutationen der Erbinformation sind irreparabel, nachträgliche Reparaturen sind nicht möglich. Bei somatischen DNA-Veränderungen besteht zumindest die Möglichkeit, diese mit zelleigenen Mechanismen zu verhindern (→ Abschnitt 3.3).
Generelle Konsequenzen veränderter Erbinformationen für Zellprozesse und Gewebestrukturen
Veränderte DNA‑Codes der ursprünglichen Erbinformation können Veränderungen innerer Zellprozesse zur Folge haben, aus denen Veränderungen nach außen gerichteter Zellaktivitäten resultieren. Durch Erbinformationsveränderungen bedingte Zellprozessveränderungen sind in sämtlichen Phasen der Embryogenese und nach deren Beendigung im fertigen Organismus möglich.
Je nachdem, wieviele, welche und auf welche Weise Peptid‑ oder ncRNA‑Codes mutieren, kommt es zu unterschiedlichen Veränderungen ‑ mit entsprechend mehr oder weniger schwerwiegenden zellphysiologischen Konsequenzen. In Zellen des Zentralnervensystems relevante Mutationen können dort zu einem Szenario führen, das dem der ersten Stufe des 3‑Stufen‑Modells entspricht (→ Abschnitt 1.3) und bilden damit ggf. den Auftakt weiterer Veränderungen gemäß der Stufen 2 und 3 dieses Modells. Das bedeutet: Derart bedingte Prozessänderungen können mittel‑ bis langfristig auch zu strukturellen Anpassungen bzw. Veränderungen des Gehirns führen (→ folgender Abschnitt 4.7.5).
Zellphysiologische Konsequenzen veränderter ncRNA-Codes
In Abbildung 27 werden zellphysiologische bzw. unmittelbare Folgen mutierter Erbinformations‑ Codes exemplarisch ausschließlich anhand veränderter ncRNA‑Codes (tRNA, rRNA und die wichtigen miRNA) dargestellt, denn die Mechanismen sind grundsätzlich vergleichbar mit denen erblicher Genmutationen und machen damit eine redundante Darstellung beider Mechanismen überflüssig.
Das hat den zusätzlichen Vorteil, dass die Folgen mutierter ncRNA‑Codes direkt im Diskussionsfokus stehen, was aufgrund ihrer Neuartigkeit sinnvoll ist, denn die Auswirkungen erblich veränderter ncRNA‑Moleküle sind ja der eigentlich neue Aspekt der hier vertretenen Sicht.
Beide Teilgraphiken in Abbildung 27 sind darüber hinaus wegen der grundsätzlichen Parallelen zwischen somatischen und (ncRNA‑)Mutationen auf der Erbinfomation fast identisch mit denen von Abbildung 25 des Abschnitts 4.2.
ABBILDUNG 27: AUSWIRKUNGEN VON ncRNA-CODEVERÄNDERUNGEN DER ERBINFORMATION
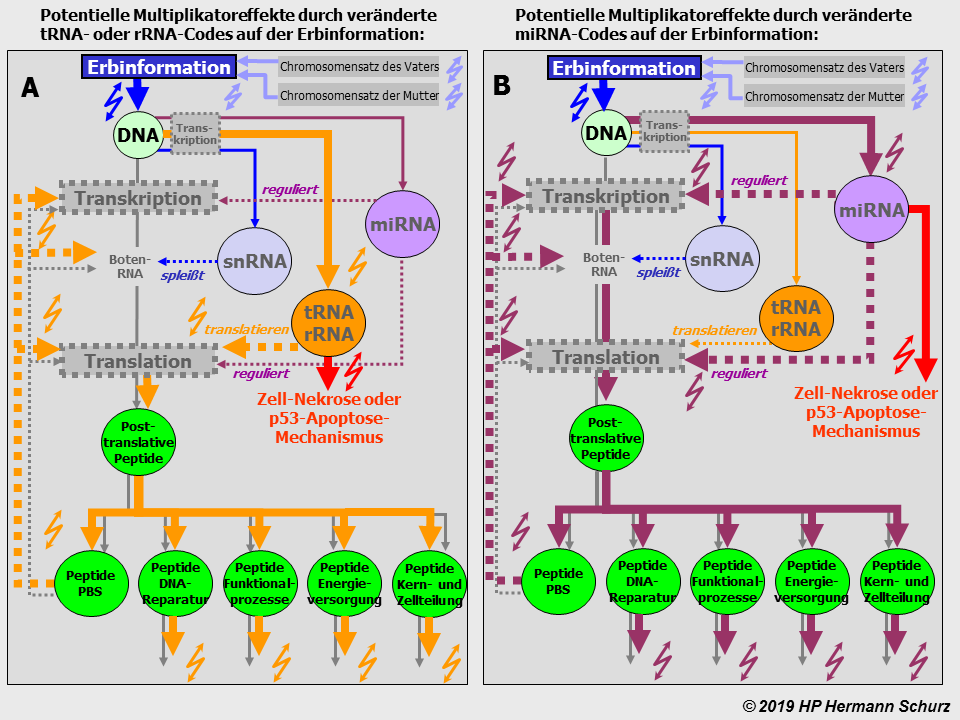
Abbildung 27: Veränderungen der urspünglichen Erbinformation entstehen entweder durch Geschehnisse vor oder während der Keimzellenverschmelzung. Chromosomenveränderungen sind daher entweder langfristig erblich-familiär oder durch einmalige Mutationen des väterlichen oder mütterlichen Chromsomensatzes bedingt, ebenfalls durch Fehler bei der Entstehung der ersten Zelle des neuen Organismsus (Zygote). Derartige DNA-Veränderungen können sowohl Gene als auch nc-RNA-Codes betreffen und sind später in sämtlichen Zellen des Körpers zu finden, haben aber nur in den Zellen eine Wirkung, in denen sie ausgelesen (transkribiert) werden müssen. Die Abbildungen zeigen die unmittelbaren (primären) Wirkungen von ncRNA-Mutationen in einer Zelle. Aufbau und Entwicklung des Organismus werden vor allem mit ncRNA-Molekülen durchgeführt und zelltypspezifisch gesteuert. Mutationsgeschädigte tRNA und rRNA können zu Fehlern bei der Übersetzung (Translation) der Boten-RNA in Peptide führen, mutationsgeschädigte miRNA zu Fehlern der Regulation dieser Prozesse. Die Probleme können funktionsübergreifend alle Zellprozessbereiche betreffen und sowohl eine korrekte Embryogenese als auch die reibungslose Funktionalität der fertigen Organe danach bedrohen. Kausaltheoretisch können durch ncRNA-Mutationen im Zentralnervensystem Entwicklungen in Gang gesetzt werden, die im 3-Stufen-Modell beschrieben sind und in affektrelevanten Hirnarealen zu Affektstörungen führen.
4.7.5 Erbliche Mutationen und Merkmale
Einflüsse multipel veränderten Erbguts auf körperlich-charakterliche Merkmale oder Begabungen
Relativ leicht nachzuvollziehen ist das Zustandekommen äußerlicher (Körper‑)Merkmale durch polygenetische Prädispositionen. Ein Beispiel ist die Progenie ‑ auch „Habsburger Unterlippe“ genannt ‑, eine Kieferfehlstellung, die bei Mitgliedern des Habsburger Adelsgeschlechts seit Jahrhunderten gehäuft auftritt und im Volksmund als „prominentes Kinn“ bezeichnet wird, in der Gesamtbevölkerung jedoch nur mit einem geringen Anteil von wenigen Prozent zu finden ist. Eine Progenie hat häufig Einschränkungen der Kiefernutzung zur Folge, in der Regel steht jedoch der ästhetische Aspekt im Vordergrund.
Es sind wahrscheinlich viele Gene an der Entstehung der Progenie beteiligt, jedoch wird auch eine ‑ eher unwahrscheinliche ‑ monogenetische Ursache diskutiert. Einige Forscher vermuten im speziellen Fall der Habsburger einen hohen Inzuchtkoëffizienten als eine Ursache (vgl. G. Will, Morphologische Aspekte der skelettalen Klasse III‑Fehlbildung unter besonderer Berücksichtigung basikranialer Bezüge, Medizinische Fakultät der Universität Greifswald, 2006, https://d‑nb.info/...).
Aber auch bei nicht pathologischen Körpermerkmalen, beispielsweise der Form von Augen, Nase, Kopf, Körper oder dem Gesichtsausdruck, lassen sich erbliche Einflüsse leicht feststellen. Fast jeder kennt Beispiele aus der eigenen Familie, innerhalb der sich bestimmte auffällige Körpermerkmale über Generationen hinweg wiederholen.
Selbst Charaktermerkmale und Begabungen sind innerhalb von Großfamilien oder Sippen auffällig häufig vertreten. Beispiele sind die Familien Bach, Mozart, Strauss oder Wagner und die generationenübergreifende Musikalität vieler ihrer Mitglieder. Sowohl Ludwig van Beethovens Großvater als auch Vater arbeiteten als Musiker. In der Popmusik ist die US-amerikanische Familie Jackson ein Beispiel. All das nährt die Vermutung, Charaktermerkmale bzw. Begabungen beruhten ebenfalls auf polygenetischen Ursachen.
Bei Charaktermerkmalen oder Begabungen sind die Zusammenhänge allerdings komplexer. Denn neben der Schwierigkeit, beispielsweise den Musikalitätsbegriff ausreichend genau zu definieren, spielen hier mit hoher Sicherheit auch erworbene Dispositionen durch ein musikalisches Umfeld eine Rolle. Die Wahrscheinlichkeit, dass Mitglieder einer Musikerfamilie automatisch auch einen innigen Kontakt mit der Musik haben und schon früh musikalisch intensiv unterrichtet werden, ist sehr hoch. Das spricht für eine Kombination polygenetischer und erworbener Dispositionen. Danach könnte ein Mensch mit erblich mitbedingter künstlerisch-musikalischer Begabung diese allerdings auch verlieren, wenn er im familiären Umfeld keine musische Förderung erfährt (Quelle: C. Renner, Wer ist musikalisch?, Institut für Musik und Musikwissenschaft, TU Dortmund, 2003, http://studium.claimaster.de/...).
Da Musikalität zweifelsfrei eine Gehirnleistung ist, vermuteten Neurowissenschaftler dort lange Zeit die Existenz eines „Musikzentrums“. Diese Annahme hat sich aber als falsch herausgestellt, vielmehr wird Musik in verschiedenen Hirnbereichen verarbeitet, unter anderem in der primären Hörrinde und der Amygdala, im Schläfenlappen, motorischen Cortex, Gyrus cinguli, Gyrus parahippocampalis und im Hippocampus. Das Kleinhirn ist beim Spielen von Instrumenten wichtig, um feinmotorische Bewegungen auszuführen. Außerdem verarbeiten beide Cortexhemisphären Musik und nicht nur ‑ wie zunächst angenommen wurde ‑ die rechte Hälfte, wenn auch auf unterschiedliche Weise, wobei die linke Seite hauptsächlich analytische Aufgaben übernimmt.
Aus kausaltheoretischer Sicht ist eine Begabung oder ein Charakterzug auf der Kausalebene 1 (→ Kapitel 1) durch optimale Ausprägungen dieser für das Merkmal notwendigen Nerven- bzw. Hirnstrukturen charakterisiert. Hier spielen Anzahl, Funktionsfähigkeit und Vernetzung der Nervenzellen und der Zustand der Gliazellen in den für die Begabung bzw. den jeweiligen Charakterzug relevanten Hirnarealen entscheidende Rollen.
Viele Gene und Genkombinationen sind sowohl für den Aufbau dieser Strukturen als auch für die Qualität dort stattfindender Aktivitäten mitverantwortlich und schaffen damit die Basis musikalischer Begabung bzw. eines individuellen Charakterzugs.
Es ist an dieser Stelle unerheblich, welche Prozesse auf molekularer Ebene genau verantwortlich sind ‑ in Abschnitt 4.7.4 wurde diese Frage schon erörtert ‑, denn es geht nur um das Prinzip. Gene sind in erster Linie nicht direkt für Begabungen oder Charakterzüge im funktionalen Sinne verantwortlich, sondern für den Aufbau und die Funktionalität dafür notwendiger Gehirnstrukturen:
Polygenetischer Einfluss → Ausbildung musischer Hirnstrukturen → Musische Begabung
Polygenetischer Einfluss → Ausbildung persönlichkeitsrelevanter Hirnstrukturen → Charakterzug
Eine Kieferfehlstellung, die Nasenform bzw. andere äußerliche Merkmale, Begabungen und Charakterzüge basieren damit immer auf demselben Prinzip, nämlich einem polygenetisch gesteuerten individuellen Gewebestrukturaufbau und der Beeinflussung dort stattfindender Prozesse. Bei Hirnleistungen, wie Begabungen oder Charakterzüge, sind es dann eben die speziellen Strukturen und Funktionen der für die Merkmale zuständigen Areale des Gehirngewebes, deren Entwicklung polygenetisch optimal beeinflusst und ausgestaltet werden muss.
Wichtig ist auch hier eine multikausale Betrachtungsweise. Denn neben der schon oben erwähnten fehlenden Förderung durch die Eltern können daher auch Störungen der embryonalen Entwicklung des Nervensystems oder spätere Schädigungen eine gute genetische Basis zunichte machen. Prinzipiell können alle im Kapitel 4 diskutierten Noxen eine auf genetischen Faktoren basierende musikalisch-künstlerische Begabung hintertreiben, indem sie die genetisch bedingten musischen Hirnstrukturen unvorteilhaft verändern.
Polygenetische Prädispositionen, Hirnstrukturen und primäre Affektstörungen
Um die Frage beantworten zu können, auf welche Weisen Erbinformationen an der Entstehung primärer Affektstörungen mitwirken, ist die zuvor geführte Diskussion polygenetischer Einflüsse auf Körpergewebestrukturen hilfreich. Auch die Erkenntnis, dass Musikalität bzw. künstlerische Begabungen von Hirnregionen beinflusst und gesteuert werden, die auch bei der Affektsteuerung Aufgaben übernehmen, nämlich Amygdala, Gyrus cinguli, Hippocampus und ggf. Gyrus parahippocampalis oder weitere gemeinsam genutzte Areale, hilft beim Verständnis dieser komplexen Zusammenhänge.
Denn der Kern aller kausaltheoretischen Überlegungen ist ja gerade die Annahme, Affektive Störungen beruhten auf funktionalen und strukturellen Mängeln dieser Hirnareale (→ Kapitel 1). Und wenn polygenetische Prädispositionen letztlich charakterliche Eigenarten, Begabungen oder Nicht‑Begabungen durch ihre Einflüsse auf diese Hirnstrukturen mitzubestimmen in der Lage sind, muss das auch für Affektive Störungen gelten, deren Genese dann ebenfalls von polygenetischen Prädispositionen abhängig sein würde.
Menschen mit entsprechenden polygenetischen Prädispositionen verfügten nach dieser Annahme über funktional und strukturell vorbelastete instabile affektverarbeitende Hirnstrukturen und unterlägen damit einer größeren Gefahr, im Laufe ihres Lebens an einer Affektstörung zu erkranken, denn eine Belastung mit weiteren Noxen würde das schon fragile System weiter schädigen, die Gefahr eines Erkrankungsausbruchs würde steigen. Strukturelle Instabilität bedeutet beispielsweise, dass die Anzahl der Nerven- und/oder Gliazellen in den affektrelevanten Arealen reduziert ist oder die Vernetzungsmuster der Nervenzellen suboptimal sind.
Polygenetische Einflüsse auf die Genese affektiver Erkrankungen sollten in Familienverbänden anhand statistisch messbarer erhöhter Häufigkeiten für eine Depression, Bipolare Störung oder Manie nachweisbar sein.
Erblich bedingte ncRNA-Mutationen in der wissenschaftlichen Diskussion
Die Menge menschlicher Gene wird aktuell zwischen knapp unter 20.000 und etwa 30.000 geschätzt. Diese Anzahl umfasst allerdings nur 2% aller DNA‑Codes, die Peptide ‑ hauptsächlich Enzyme oder Proteine ‑ betreffen, einschießlich der Codes von Strukturen, die mit dem Ablesen der Gene im Zusammenhang stehen, beispielsweise Promotoren.
Diese Menge macht aber nur ca. 2% der Anzahl aller DNA‑Codes aus (→ ausführlich in Abschnitt 4.10). Die wichtigen ncRNA‑Codes sind darin nicht enthalten ‑ aber gerade ncRNA-Moleküle spielen in den hier zugrundeliegenden Modellen eine bedeutende Rolle als hochrelevante Kausalfaktoren (→ Relevanzbewertung in Abschnitt 3.4).
Danach sind Analysen erblicher Mutationen, die nur Gene und keine ncRNA‑Codes berücksichtigen, wenig hilfreich, die Rolle der ursprünglichen Erbinformation auf die Krankheitsgenese zu verstehen.
Wie ist jedoch zu erklären, dass es diese Missverständnisse auch heute noch gibt, und die Bedeutung der ncRNA-Moleküle weiter unterschätzt wird, obwohl seit 1998 durch die Arbeiten von Andrew Fire und Craig Mello Hinweise vorliegen (Quelle: Fire, Mello et al., Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans, Nature Journal no. 391, 2/1998, http://www.ncbi.nlm.nih.gov/...), dass es neben Genen noch andere wichtige DNA-Strukturen gibt?
Es liegt vor allem an zeitlich parallel stattfindenden Aktivitäten und einigen weiteren Umständen:
- Die Sequenzierung des menschlichen Genoms wurde 1990 gestartet und 2001 abgeschlossen.
- Der Fokus lag auf Genen von Enzymen und Proteinen.
- 1990 waren Existenz und Bedeutung der meisten ncRNA-Moleküle noch unbekannt.
- Das Sequenzierungsprojekt war multinational organisiert und dadurch schwer koordinierbar.
- Andrew Fire und Craig Mello haben vergleichsweise spät ‑ nämlich erst 1998 ‑ die Existenz Proteinbiosynthese-modulierender ncRNA-Moleküle nachgewiesen.
- Die Entdeckung einzelner ncRNA-Moleküle und ncRNA-Gruppen erfolgt seitdem „häppchenweise“.
- Über Funktionen einzelner ncRNA weiß man - bis heute - noch relativ wenig.
Das Thema wird in Abschnitt 4.10, der ganz den ncRNA gewidmet ist, noch intensiver erörtert. Daher sollen die kurzen Hinweise an dieser Stelle genügen.
4.7.6 Polygenetische Prädispositionen von Affektstörungen in Empirie und Genforschung
Zur empirischen Erforschung polygenetischer Prädispositionen gibt es drei verschiedene Möglichkeiten:
- Familienstudien,
- Zwillings- und Adoptionsstudien und
- Studien auf Grundlage molekulargenetisch fundierter Analysen.
Mit Familienstudien werden die Verteilung von Erkrankten und Erkrankungshäufungen innerhalb eines Familienverbands oder einer Sippe untersucht. Zur Beweisführung einer polygenetischen Ursache sind Familienstudien nicht geeignet. Ergebnisse können maximal als Möglichkeit polygenetischer Beteiligung interpretiert werden, da die Methode Rückschlüsse auf die Anteile genetischer Prädispositionen oder externer Dispositionen, beispielsweise Erziehung, nicht zulässt.
Mit Hilfe eineiiger Zwillinge werden bei Zwillingsstudien Merkmalübereinstimmungen (Konkordanz) und Erblichkeitsquoten (Heritabilität) einer Erkrankung statistisch berechnet, so dass in vielen Fällen mit hoher Sicherheit polygenetische Zusammenhänge belegt oder widerlegt werden können.
Bei Adoptionsstudien werden sozial‑ und umweltbedingte Einflüsse auf die Studienteilnehmer durch das zusätzliche Adoptionskriterium herausgefiltert. Aufgrund der vergleichsweise geringen Zahl zur Verfügung stehender eineiiger Zwillinge als Studienteilnehmer ist es häufig schwierig, aussagekräftige Studien durchzuführen.
Molekulargenetisch fundierte Studien in Form von Assoziationsuntersuchungen oder Kopplungsanalysen gibt es aufgrund dazu notwendiger Gen-Sequenzierungstechniken erst seit neuester Zeit. Wegen technischer Limitationen sind deren Aussagewerte allerdings ebenfalls beschränkt.
Familienstudien
Dass Affekterkrankungen bei verwandtschaftlich verbundenen Personen gehäuft auftreten, wurde in vielen Studien bestätigt. Eine Übersicht bietet die Zeitschrift für Kinder- und Jugendpsychiatrie und Psychotherapie (Quelle: Schulte-Körne G., Allgaier A.-K., Genetik depressiver Störungen, Zeitschrift für Kinder- und Jugendspsychiatrie und Psychotherapie, Verlag Hans Huber, Hogrefe AG, Bern/Schweiz 2008, http://www.kjp.med.uni-muenchen.de/...).
In der Regel werden verwandtschaftliche Beziehungen ersten und zweiten Grades untersucht. Verwandte ersten Grades sind aus Probandensicht Vater, Mutter, Geschwister und eigene Kinder, die Verwandten zweiten Grades sind entweder eine Generation in der direkten Linie davon entfernt (Großeltern, Enkel) oder die Geschwister der Eltern (Onkel, Tanten) und deren Kinder (Neffen, Nichten).
- Rende et al., 2007: Manisch-depressiv erkrankte Jugendliche hatten häufiger mindestens einen affektiv erkrankten Verwandten ersten Grades und mindestens einen affektiv erkrankten Verwandten zweiten Grades in ihrer Familie. Bei einer Erstmanifestation der Erkrankung vor dem 12. Lebensjahr war die Rate höher (Quelle: Rende et al., 2007, Childhood-onset bipolar disorder: Evidence for increased familial loading of psychiatric illness, Journal of the American Academy of Child and Adolescent Psychiatry/46).
- Hirshfeld-Becker et al., 2006: Kinder von Eltern mit einer Bipolaren Störung haben eine signifikant höhere Wahrscheinlichkeit, ebenfalls zu erkranken. In den Fällen von Major Depression und Panikstörungen wurden keine Unterschiede festgestellt (Quelle: Hirshfeld-Becker et al., 2006, Psychopathology in the young offspring of parents with bipolar disorder: a controlled pilot study, Psychiatry Research/145).
- Mondimore et al., 2006: Die Wahrscheinlichkeit eines chronisch rezidivierenden Verlaufs der Depression steigt für Verwandte ersten Grades, wenn bei der zu untersuchenden Person ein chronisch rezidivierender Verlauf diagnostiziert wurde (Quelle: Mondimore et al., 2006, Familial aggregation of illness chronicity in recurrent, early-onset major depression pedigrees, American Journal of Psychiatry/163).
- Weissmann et al., 2006: Für diese Langzeitstudie wurden zwei Gruppen Jugendlicher 20 Jahre lang beobachtet, deren Eltern entweder an einer Major Depression erkrankt waren (Gruppe 1) oder gesund waren (Gruppe 2). Die Gruppe 1 der Kinder depressiver Eltern hatte eine signifikant höhere Erkrankungsrate für eine Major Depression (65% gegenüber 27%). Auch die Rate der Erkrankung für die Bipolare Störung war mit 14% gegenüber 0% signifikant erhöht. Die Rate für Dysthymie war mit 24% gegenüber 13% zwar erhöht, wurde aber als nicht signifikant betrachtet (Quelle: Weissman et al., 2006, Offspring of depresse parents: 20 years later, American Journal of Psychiatry/163).
- Weissmann et al., 2005: Drei-Generationen-Studie mit 161 Probanden, wobei die Einflüsse von Eltern und Großeltern auf die Erkrankungswahrscheinlichkeit der Probanden gemessen wurde. Es gab vier Einflussgruppen (Eltern und Großeltern ohne Depression, Eltern mit Depression und Großeltern ohne Depression, Eltern ohne Depression und Großeltern mit Depression, Eltern und Großeltern mit Depression). Die Erkrankungswahrscheinlichkeit eines Probanden war davon abhängig, ob mindestens ein Großelternteil von der Erkrankung selber betroffen war (Quelle: Weissman et al., 2005, Families at high and low risk for depression: a 3-generation study, Archives of General Psychiatry/62).
- Lieb et al., 2002: Von etwa 2.400 Jugendlichen hatten diejenigen ein höheres Erkrankungsrisiko, bei deren Eltern eine Major Depression diagnostiziert wurde. Die Rate stieg, wenn beide Elternteile erkrankt waren. Untersucht wurden die Probanden auf eine Major Depression (12,3% beide Eltern gesund, 26,1% ein Elternteil erkrankt und 28,5% beide Eltern erkrankt), auf eine Bipolare Störung (1%, 3,2%, 5,7%) und die Dysthymie (1,8%, 5,3%, 6,8%) (Quelle: Parental major depression and the risk of depression and other mental disorders in offspring: a prospective-longitudinal community study, Archives of General Psychiatry/59).
- Zubenko et al., 2001: 81 Erwachsene bis zum 25. Lebensjahr mit einer früh diagnostizierten rezidivierenden Depression im Vergleich mit Verwandten bis zum vierten Grad. Die Erkrankungswahrscheinlichkeit über die bis dahin gelebte Zeit (Lebenszeitprävalenz) für die Verwandten ersten Grades war signifkant höher als die der entfernteren Verwandten, wobei nur diejenigen zweiten Grades eine ausreichend hohe Anzahl von 780 Teilnehmern aufwies. Es ergaben sich für Verwandte ersten Grades bei der Major Depression 37,8% und bei zwei Formen der Bipolaren Störungen jeweils 2,5%. Bei der entfernteren Verwandtschaft betrugen die Wahrscheinlichkeiten 18,4% für Major Depression und 1,2% bzw. 0,8% für beide bipolaren Formen (Quelle: Zubenko et al., 2001, Malignancy of recurrent, early-onset major depression: a family study, American Journal of Medical Genetics/105).
- Kovacs et al., 1997: Die Studie ergab bei Kindern mit einer frühen Affekterkrankung (Major Depression, Dyhsthymie, Bipolare Störung) für deren Familien ein fünffach erhöhtes Erkrankungsrisiko eines weiteren Familienmitglieds an Major Depression (nur Sekundärquelle: Schulte-Körne G., Allgaier A.-K., Genetik depressiver Störungen, → oben).
- Williamson et al., 1995: Eine Gruppe Jugendlicher mit Major-Depression-Diagnose und eine mit gesunden Probanden wurden mit Verwandten ersten und zweiten Grades verglichen. Die Lebenszeitprävalenz für eine Major Depression bei den Verwandten ersten Grades für die Gruppe der depressiven Probanden betrug 25% gegenüber 13% bei der gesunden Kontrollgruppe. Bei den Verwandten zweiten Grades wurde keine signifikante Erhöhung der Raten festgestellt (nur Sekundärquelle: Schulte-Körne G., Allgaier A.-K., Genetik depressiver Störungen, → oben).
- Weller et al. verglichen 1994 eine Gruppe von 63 an einer Major Depression erkrankten Kinder mit einer zweiten gleichgroßen Gruppe von gesunden Kindern. Familienmitglieder ersten Grades von kranken Kindern hatten eine signifikant höhere Erkrankungswahrscheinlichkeit gegenüber der gesunden Kontrollgruppe (65% gegenüber 37%). Bei der Bipolaren Störung lautete der Gegensatz 13% zu 5%, was zwar auch erhöht ist, jedoch als nicht signifikant betrachtet wurde. Umgekehrt erkrankten Mütter von Kindern der ersten Gruppe häufiger sowohl an einer Major Depression (63% gegenüber 37%) als auch an einer Bipolaren Störung (8% gegenüber 0%) (nur Sekundärquelle: Schulte-Körne G., Allgaier A.-K., Genetik depressiver Störungen, → oben).
Zwillingsstudien
Erste Versuche des Nachweises erblicher Zusammenhänge bei Affekterkrankungen mit Hilfe von Zwillingsstudien gab es schon im frühen 20. Jahrhundert, wobei die Aufmerksamkeit der Forschung zu Beginn vor allem auf die Bipolare Störung gerichtet war. Die Meinung, dass genetisch-familiäre Einflüsse bei der manisch-depressiven Erkrankung von Bedeutung sind, hat sich bis heute durch zahlreiche Studienergebnisse gefestigt (vgl. Maier W., Klinik für Psychiatrie und Psychotherapie der Universität Bonn, Genetik der Depression, Bundesgesundheitsblatt, Bonn 2004, http://link.springer.com/...).
So ist die Rate der Übereinstimmung (Konkordanzrate) bei monozygoten Zwillingen fast immer signifikant höher als die der dizygoten Zwillinge, was auf einen genetischen Zusammenhang hinweist. Allerdings lag die Rate immer deutlich unterhalb von 100%. Es kommt also vor, dass auch bei eineiigen Zwillingen nur ein Geschwisterteil von einer manisch-depressiven Erkrankung betroffen ist. Dies ist ein klarer Hinweis darauf, dass auch andere Einflüsse bzw. erworbene Dispositionen bei der Pathogenese der bipolaren Erkrankung von Bedeutung sind.
Im Laufe der Zeit weiteten sich die Zwillingsuntersuchungen aus und auch bei der unipolaren Affektstörung wurden höhere Konkordanzraten festgestellt. Ebenfalls gelang es, für die Bipolare Störung einen höheren erblichen Anteil im Vergleich mit der unipolaren Affektstörung nachzuweisen.
So ergab die von Peter McGuffin et al. im Jahre 2003 veröffentlichte Zwillingsstudie eine Konkordanzrate von 40% bei monozygoten Zwillingen in Bezug auf die Bipolare Störung, während dizygote Geschwisterpaare lediglich eine Rate von 5,4% aufwiesen. Dieselbe Studie ergab für die unipolare Form bei monozygoten Zwillingen eine Konkordanzrate von 44,1%, die aber noch immer signifikant höher war als die Rate bei den dizygoten Geschwistern in Höhe von 20,2%.
Nach Schulte‑Körne und Allgaier kann heute mit Sicherheit festgestellt werden, „dass die Heritabilität bipolarer Erkrankungen deutlich höher ist als bei unipolaren Erkrankungen. Studien jüngeren Datums ermittelten für bipolare Störungen Konkordanzraten zwischen 40 und 70% für monozyote und zwischen 5 und 10% für dizygote Zwillinge (...), die Heritabilität liegt zwischen 70 ‑ 90% (...). Für unipolare Depressionen werden Konkordanzraten von 23 ‑ 50% bei monozygoten und 14 ‑ 37% bei dizygoten Zwillingen berichtet (...). Die Heritabilität für unipolare Erkrankungen liegt in der Mehrzahl der Studien im Bereich von 35 ‑ 70% (...).“ (Quelle: Gerd Schulte‑Körne G., Allgaier A.‑K., Genetik depressiver Störungen, Zeitschrift für Kinder- und Jugendspsychiatrie und Psychotherapie, Verlag Hans Huber, Hogrefe AG, Bern/Schweiz 2008, http://www.kjp.med.uni-muenchen.de/...).
Die nachfolgende Analysenauswahl belegt die zitierten Sichtweisen (Sekundärquelle: Gerd Schulte-Körne G., Allgaier A.-K., Genetik depressiver Störungen, → oben):
- Kendler et al. untersuchten 2006 bei ca. 15.500 Zwillingspaaren das Merkmal der Major Depression in den drei geschlechtsspezifischen Gruppen W-W, M-M und W-M. Es ergaben sich folgende Konkordanzraten in den Gruppen, unterschieden nach monozygotischen (mz) bzw. dizygotischen (dz) Paaren:
W-W 44% mz / 16% dz, M-M 31% mz / 11% dz und M-W 11% dz. Das Studienteam errechnete eine Heritabilität bei Frauen von 42% und bei Männern von 29%.
- Kieseppä et al., 2004: Hier war die Bipolare Störung Untersuchungsmerkmal der Zwillingsstudie, wobei die dizygoten Paare gleichgeschlechtlich waren. Die Konkordanzraten betrugen 43% bei den monozygoten und 6% bei den dizygoten Zwillingspaaren, woraus eine hohe Heritabilität von 93% berechnet wurde.
- Die Zwillingsstudie von McGuffin et al. aus dem Jahre 2003 und deren Konkordanzraten wurden oben schon erörtert. Für das Merkmal der Bipolaren Störung wurden 30 monozygotische und 37 dizygotische Paare und für die unipolare Form 68 monozygotische und 109 dizygotische Paare untersucht. Auffällig ist, dass das Studienteam für beide Erkrankungen eine hohe Heritabilität von 85% für die Bipolare Störung und 72% für die unipolare Form berechnete, was im Gegensatz zu den Ergebnissen der meisten anderen Studien steht, zum Beispiel auch der von Kenneth Kendler aus dem Jahre 1995, die weiter unten erwähnt ist.
- Die Basis der von Glowinski et al. 2003 durchgeführten Studie waren 1.708 weibliche Zwillingspaare zwischen dem 12. und 23. Lebensjahr, die zu 55% monozygot und zu 45% dizygot waren. Es ergaben sich folgende Konkordanzraten in vier Altersgruppen, die Heritabilität lag bei 40,4%:
12. - 14. J. 10% mz / 0% dz, 15. - 16. J. 21% mz / 27% dz, 17. - 18. J. 33% mz / 17% dz und
19. - 23. J. 45% mz / 13% dz.
- Cardno et al. untersuchten 1999 die genetische Prädisposition der Manie und ermittelten eine hohe Heritabilität von 84%.
- Die Zwillingsstudie von Kendler et al. aus dem Jahre 1999 bezieht sich auf die Major Depression und ist vom Aufbau vergleichbar mit Kendlers Studie von 2006 mit folgenden Ergebnissen:
W-W 47,6% mz / 42,6% dz, M-M 31,1% mz / 25,1% dz, M-W bzw. W-M dz 32,5% bzw. 21,5%. Sowohl für Frauen als auch für Männer betrug die Heritabilität 39%.
- Bei der 1998 von Lyons et al. durchgeführten Studie an 3371 männlichen Zwillingspaaren der Geburtsjahre zwischen 1939 und 1957 aus Vietnam mit Kriegserfahrungen wurden Major Depression und Dysthymie untersucht. In Summe ergab sich für monozygotische Paare eine Konkordanzrate von 22,5%, während die für dizygotische Paare 14% betrug.
Interessant sind die Ergebnisse, wenn man zwischen einem leichten (2,4% vs. 5,2%), mittelgradigen (3,3% vs. 5,1%) und schwer-psychotischen Erkrankungsgrad (14,7% vs. 6,1%) differenziert. Erst bei der schweren Erkrankungsform zeigt sich ein signifikanter erblicher Einfluss. Dies ist zwar kein Beweis, aber ein Hinweis darauf, dass im vietnamesichen Umfeld der genetische Anteil eine geringere Rolle spielt gegenüber den erworbenen Dispositionen, die in traumatisierenden Kriegserfahrungen ihren Urspung haben könnten.
Eine weitere Auswertungsvariante bestand im Konkordanzratenvergleich der Gruppe mit einem Ersterkrankungsalter vor dem 30. Lebensjahr bzw. danach. Für die erste Variante ergaben sich 22,1% vs. 6,2% und für die Späterkrankten 7,7% vs. 3,8%. Es ist eine häufig zu machende Erfahrung, dass sich der genetische Einfluss bei der Depresssion vor allem im frühen Erkrankungsalter zeigt.
- Eine im Jahre 1995 durchgeführte Studie zeigt nochmal deutlich die Unterschiede der Heritabilitäten von Major Depression und Bipolarer Störung. Kenneth Kendler und sein Team untersuchten 269 schwedische Zwillingspaare und ermittelten für die Major Depression Konkordanzraten von 43,4% für monozygotische und 24,8% für dizygotische Paare, für die Bipolare Störung jedoch 38,% vs. 4,5%, woraus sich eine wesentlich stärkere Erblichkeit der Bipolaren Störung ableiten lässt. Dementsprechend wurde eine Heritabilität bei der Bipolaren Störung von 79% gegenüber 60% bei der Major Depression errechnet.
Molekulargenetisch fundierte Studien
Bei einer Linkage- oder Kopplungsanalyse werden Regionen von Chromosomen mit Hilfe eines speziellen Genkartierungsverfahrens eingegrenzt, auf denen Krankheitsgene vermutet werden. Dazu bedient man sich genetischer Marker, deren Position auf dem Chromosom bekannt sind und die dann auf entsprechende Genregionen verweisen.
Es werden also nicht einzelne Gene, sondern größere Genregionen ermittelt. Das unbekannte Krankheitsgen bzw. mehrere davon, auch Suszeptibilitäts- oder Kandidatengene genannt, werden in dieser Region vermutet und „gekoppelt“ mit der betreffenden Genregion vererbt.
Die Darstellung der Abläufe und Einzelheiten des Verfahrens sind hier weniger interessant. Interessanter sind die Ergebnisse und die Relevanz derartiger Untersuchungen für Affektstörungen, die seit den 1980er Jahren durchgeführt werden.
Über die Bipolare Störung liegen mehr Untersuchungen vor als über die unipolare, was wohl auch mit den Erkenntnissen zu tun hat, die aus den Familien- und Zwillingsstudien gewonnen wurden und die auf eine wesentlich höhere Erblichkeit (Heritabilität) der Bipolaren Störung verweisen.
Aufgrund nur weniger Kopplungsanalysen wurden Chromosomregionen publiziert, die als Kandidatenregionen für die unipolare Depression gelten (vgl. Gerd Schulte‑Körne G., Allgaier A.‑K., Genetik depressiver Störungen, Zeitschrift für Kinder- und Jugendspsychiatrie und Psychotherapie, Verlag Hans Huber, Hogrefe AG, Bern/Schweiz 2008, http://www.kjp.med.uni-muenchen.de/... und Hünnerkopf R., Lesch K.-P., Die Genetik der Depression, Zeitschrift Medizinische Genetik, Deutsche Gesellschaft für Humangenetik e. V., Unterhaching 2006).
Dass sich mehrere Lokalisationen ergaben, lag an den unabhängig voneinander durchgeführten Kopplungsanalysen. Um einzelne Loci zu verifizieren, mussten diese in weiteren unabhängigen Studien untersucht werden. Die fett hervorgehobenen Genbereiche der ersten Reihe sind diejenigen, die in mindestens zwei Studien repliziert werden konnten:
- 1p36, 1q, 2q, 3centr, 4q, 5q, 6q, 7p, 8p, 11q (2), 12q, 15q, 18q
- 12q22-23.2, 12q23.3-q24.11, 13q31.1-q31.3, 15q25-q26
Bei einer Studie mittels Kopplungsanalyse mit 81 Familien stellte sich heraus, dass das Protein CREB1, ein Transkriptionsfaktor, der die Synthese vieler Peptide steuert, ein Kandidatengen für die unipolare Depression sein könnte (Quelle: Zubenko G. S. et al., Genetic linkage of region containing the CREB1 gene to depressive disorders in women from families with recurrent, early‑onset, major depression, American Journal of Medical Genetics, Vol. 114 (8), S. 980 ‑ 987, Wiley‑Blackwell, Hoboken, N. J./USA, 2002 , https://onlinelibrary.wiley.com/...).
Jedoch muss klargestellt werden, dass alle Kopplungsanalysen bisher keine eindeutigen Ergebnisse hervorgebracht haben, und das Verfahren selber großen Ungenauigkeiten unterliegt.
Aufgrund der Mankos von Kopplungsanalysen etablierte man mit der Assoziationsuntersuchung ein weiteres Verfahren. Mit dieser Methode werden Verdachtsgene bzw. deren Varianten, die mit der Erkrankung eventuell in einem nicht näher definierten Zusammenhang stehen, bei Patienten und gesunden Probanden verglichen (Quelle wie oben).
Auch diese Form der Analyse stößt schnell an ihre Grenzen, denn aufgrund der hohen Anzahl von Genen ist es nur möglich, sich auf wenige davon für eine Untersuchung zu beschränken. Aufgrund der Akzeptanz der Monoaminmangelhypothese bei Affektstörungen wurden Gene aus dem serotonergen System als Verdachtsgene zur Untersuchung der unipolaren Depression ausgesucht. Das Verfahren bekam durch die Notwendigkeit derartiger Vorauswahlen einen spekulativen Charakter und Ergebnisse sind daher eher kritisch zu bewerten, insbesondere unter den Aspekten, dass ein Zusammenhang zwischen Serotonin und Affektiven Störungen bisher nicht nachgewiesen werden konnte und ein solcher Zusammenhang auch in den Wissenschaften auf wachsende Skepsis stößt (→ ausführlich in Kapitel 1).
Da der Serotonin-Transporter 5HTTLPR für die Wiederaufnahme des Serotonins in die Nervenzelle zuständig ist, und eine im Jahre 2003 gemachte Studie einen Zusammenhang zwischen dem Depressionsrisiko und dem 5HTTLPR-Gen ergab, konzentriert man sich seit 2003 verstärkt darauf. Weitere Objekte von Assoziationsuntersuchungen sind die Verdachtsgene von Monoaminoxidase A, Dopaminrezeptor D3 und Thyrosin-Hydroxylase.
Verschiedene Studien ergaben keine eindeutigen Ergebnisse bezüglich des Serotonin-Transporter-Gens 5HTTLPR. Einige schienen zu bestätigen, dass Veränderungen des 5HTTLPR mit Affektstörungen einhergehen, bei anderen konnte kein Zusammenhang nachgewiesen werden.
Neil Risch, ein Humangenetiker und Professor an der University of California, veröffentlichte im Jahre 2009 die Ergebnisse einer Meta-Studie über 14 Einzelstudien zum Serotonin-Transporter-Gen, mit insgesamt 14.250 Probanden (Quelle: Risch N., Herrell R., Lehner T., Kovacs M. et al., Interaction Between the Serotonin Transporter Gene (5-HTTLPR), Stressful Life Events, and Risk of Depression: A Meta-analysis, The Journal of the American Medical Association, 2009, http://www.jama.jamanetwork.com/...). Die Ergebnisse sind bis heute für die Verfechter der Serotonin-Transporter-Hypothese ein herber Rückschlag. In der Zusammenfassung der Studien-Resultate heißt es unter anderem: „In der Meta-Analyse der publizierten Daten wurde ein deutlicher Zusammenhang zwischen der Anzahl stressauslösender Lebenssituationen und einer Depression festgestellt. Kein Zusammenhang zwischen dem 5-HTTLPR-Genotyp und einer Depression ergab sich sowohl in den individuellen Studien als auch im gewichteten Durchschnitt. Ebenfalls konnten keine interaktiven Effekte zwischen dem Genotyp und stressauslösenden Lebensereignissen beobachtet werden.“
Die umfangreiche Übersichtsstudie gibt also keine Hinweise, dass das 5-HTTLPR-Gen mit einem höheren Depressionrisiko einhergeht. Diese Ergebnisse gelten sowohl für Männer und Frauen getrennt betrachtet als auch zusammen. Demgegenüber konnte die Relevanz von schweren Stressereignissen auf die Entstehung einer Depression bestätigt werden.
Auf einen weiteren Widerspruch muss noch hingewiesen werden, denn er stellt das Interesse der Forschung an Assoziationsanalysen des 5HTTLPR-Gens insgesamt infrage. Der Serotonin-Transporter bewirkt nämlich einen Rücktransport des Serotonins aus dem synaptischen Spalt in die Nervenzelle, also genau das, was ein Serotonin-Wiederaufnahmehemmer-Medikament verhindert und eine depressionsmindernde Wirkung zur Folge haben soll. Daher müsste eine 5HTTLPR-Genveränderung eigentlich dafür sorgen, dass der Serotonin-Rücktransport insgesamt schlechter funktioniert, das heißt Serotonin länger im synaptischen Spalt verbleibt. Träger dieser Genveränderung müssten nach der Monoaminmangelhypothese daher eher seltener zur Depression neigen.
Ebenfalls ist der Brain derived neurotrophic factor (BDNF) häufiger Untersuchungsgegenstand. Es handelt sich um einen Nervenwachstumsfaktor, der noch bei Erwachsenen die Gehirnplastizität beeinflusst. Veränderungen des BDNF-Gens stehen im Verdacht, sowohl an der unipolaren als auch an der Bipolaren Depression beteiligt zu sein. Diese Annahme konnte allerdings noch nicht verifiziert werden.
Untersuchungen zur Monoaminoxydase A, zum Dopaminrezeptor D3 und zur Thyrosin-Hydroxylase ergaben, zumindest für die Bipolare Störung, nur uneinheitliche Ergebnisse. Auch bei verschiedenen Untersuchungen des BDNF-Gens kam es zu uneinheitlichen und widersprüchlichen Ergebnissen.
Für die Relevanz einzelner Gene im Rahmen eines polygenetischen Geschehens gibt es bei einer Depression keine Anhaltspunkte
4.7.7 Fazit: Multiple erbliche Prädispostionen und Affektstörungen
Neben einer Zusammenfassung der wichtigsten Aspekte von Verbindungen zwischen ursprünglicher Erbinformation und Affekterkrankungen soll es im letzten Abschnitt 4.7.7 auch um die Frage gehen, ob Erbinformationen bei Affektiven Störungen eine spezielle Relevanz haben.
Zwar wurde die Erbinformation im Abschnitt 3.4 schon als mittelgradig relevant im Vergleich zu den restlichen Kausalfaktoren bewertet ‑ allerdings zunächst für ihr Potential, Zellstoffwechselstörungen im Allgemeinen zu verursachen. Da die allgemeine Relevanz eines Kausalfaktors lediglich als ein Relevanzminimum aufzufassen ist, trifft diese Bewertung nicht automatisch auf spezielle Erkrankungen zu. Es muss daher noch eingeschätzt werden, ob die Relevanz der Erbinformation bei Affektstörungen höher zu bewerten ist als mittelgradig.
Sekundäre Affektstörungen als Nebensymptomatik genetisch bedingter Haupterkrankungen
Affektstörungen treten als Neben‑ bzw. Begleitsymptomatik häufig bei Genom‑ oder monogenetischen Haupterkrankungen auf und werden als sekundär bezeichnet, da es sich nicht um eigenständige Störungen handelt. Beispiele dafür sind das Klinefelter‑Syndrom oder Chorea Huntington, die häufig von einer Depression begleitet werden. Die Zusammenhänge zwischen einer sekundärer Affektstörung und der Haupterkrankung sind kompliziert und können vielfältig sein ‑ bis hin zur Möglichkeit, dass sie völlig unabhängig voneinander auftreten und die affektive Störung dann nicht mehr als sekundär ‑ sondern als primär ‑ zu bezeichnen ist.
Darüber hinaus können sich sekundäre Affektstörungen von der Haupterkrankung abkoppeln und zu einer eigenständigen Primärerkrankung entwickeln. Das ist beispielsweise der Fall, wenn Symptome der Affekterkrankung auch bei einer erfolgreichen Behandlung der Haupterkrankung nicht verschwinden.
Einflüsse der Erbinformation auf primäre Affektstörungen
Bei eigenständigen und als primäre Affektstörungen bezeichneten Erkrankungen besteht der Verdacht, dass Kombinationen bestimmter Gene die Erkrankungsgefahren erhöhen, was als polygenetische Prädisposition bezeichnet wird. Solche Kombinationen genetischer Besonderheiten, die für sich genommen bzw. einzeln nicht zwingend pathologisch sind, wären dann in Kombination mit weiteren Ursachen bzw. Auslösern relevant.
Es gibt gesicherte Hinweise darüber, dass primäre Affektstörungen nicht monogenetisch bedingt sind, also nicht auf Defekten einzelner Gene beruhen, da regelmäßige Vererbungsmuster nicht nachweisbar sind.
Polygenetische Prädispositionen körperlicher und charakterlicher Merkmale
Dass polygenetische Prädispositionen auch bei der Entstehung körperlich‑organischer Merkmale ‑ zum Beispiel bestimmten Formen von Körper, Kopf, Nase, Augen oder Mund ‑ eine Rolle spielen, wurde mittlerweile nicht nur durch zahlreiche Familienstudien nachgewiesen, sie sind den meisten Menschen auch aufgrund eigener Erfahrungen plausibel, denn wiederkehrende Merkmale kommen in Sippen‑ oder Familienverbänden sehr häufig vor. Das gilt auch für körperlich‑somatische Erkrankungen, beispielsweise für die als Progenie bezeichnete Kieferfehlstellung.
Sehr wahrscheinlich werden auch Charaktermerkmale bzw. Begabungen wie Musikalität polygenetisch mitorchestriert. Das ist nur logisch, denn aus kausaltheoretischer Sicht bestimmt die Reizverarbeitungsqualität in Musik verarbeitenden Hirnarealen darüber mit, ob ein Mensch musikalisch veranlagt ist, und die Reizverarbeitungsqualität beruht wiederum auf hirnfunktionalen und hirnstrukturellen organischen Gegebenheiten. Auch Begabungen sind Merkmale, die letztlich auch von organischen (Hirn‑)Strukturen abhängen.
Die Genkombinationen beeinflussen die Entwicklung sowohl während der embryonalen Phase als auch danach, ihr Einfluss reicht bis ins Erwachsenenalter.
Allgemein gilt für die Wahrscheinlichkeit P:
Genkombination → organisches Merkmal → P (Körperausprägung/Erkrankung/Charaktermerkmal)
Für eine spezielle Wahrscheinlichkeit P gilt:
Genkombination → Organfunktion + Organaufbau → P (individuelles Körpermerkmal, z. B. Figur)
Genkombination → Organfunktion + Organaufbau → P (Körperliche Erkrankung, z. B. Progenie)
Genkombination → Hirnzellfunktion + Hirnstrukturierung → P (Begabung, z. B. Musikalität)Genkombination → Hirnzellfunktion + Hirnstrukturierung → P (Persönlichkeit)
Das Prinzip dieser Kausalketten kann auf Nervenerkrankungen bis hin zu Persönlichkeitsstörungen übertragen werden, da sie ebenfalls auf funktional‑strukturellen hirnorganischen Besonderheiten beruhen und deren Eintrittswahrscheinlichkeit P damit auch von polygenetischen Faktoren abhängt:
Genkombination → Hirnzellfunktion + Hirnarealstrukturierung → P (Psychiatrische Erkrankung)
Genkombination → Hirnzellfunktion + Hirnarealstrukturierung → P (Neurologische Erkrankung)Genkombination → Hirnzellfunktion + Hirnarealstrukturierung → P (Persönlichkeitsstörung)
Quintessenz: Da sowohl körperliche Merkmale bzw. körperliche Erkrankungen als auch Charakterzüge bzw. Begabungen und psychiatrisch‑neurologische Erkrankungen auf genabhängigen organischen bzw. hirnorganischen Strukturen beruhen, besteht bei allen diesen Merkmalen eine Wahrscheinlichkeit polygenetischer Mitbeeinflussung.
Eine Besonderheit von Chraktermerkmalen bzw. Begabungen besteht in der Bedeutung von Erziehung und individueller Förderung als weiteren Einflussfaktoren.
Die Nicht-Berücksichtigung der Codes nicht-codierender Ribonukleinsäuren
Leider hat die Erforschung erblicher Prädispositionen als Mitverursacher individueller Merkmale wie Körperformen, Charaktermerkmalen oder Erkrankungen einen Haken, denn es werden nur Gencodes als Einflussfaktoren untersucht. Das ist schon am Fachausdruck polygenetisch zu erkennen.
Die zahlreichen Codes nicht‑codierender Ribonukleinsäuren (ncRNA) werden dabei ignoriert. Aber gerade ncRNA spielen kausaltheoretisch entscheidende Rollen, unter anderem bei Entstehung und Verlauf degenerativer Erkrankungen.
Kausaltheoretisch werden daher die Begriffe Erbinformation statt Geninformation oder erbliche Prädisposition bzw. multiple erbliche Prädisposition statt polygenetischer Prädisposition bevorzugt, da diese auch die zahlreichen ncRNA‑Codes auf der Erbinformation umfassen.
Erbliche Prädispositionen als Trigger für Affekterkrankungen
Eine Kombination verschiedener prädispositioneller Erbinformationen (Gene, ncRNA‑Codes) kann sowohl während der embryonalen Entwicklungsphase als auch in späteren Lebensabschnitten dazu führen, zentralnervöse Strukturen suboptimal aufzubauen.
Derartige multiple erbliche Prädispositionen sind zwar in sämtlichen Zellen eines Individuums vorhanden, aber nur in Zellen relevant, in denen sie transkribiert/ausgelesen (Peptide, ncRNA) bzw. in Peptide translatiert/übersetzt (Enzyme, Proteine) werden. Auswirkungen sind daher nur zu erwarten, wenn betroffene Zellen einen indirekten oder direkten Einfluss auf die Gehirnentwicklung haben.
Ein durch prädispositionelle Erbcodekombinationen vorbelastetes Gehirn ist besonders anfällig für weitere schädigende endogene oder exogene Noxen, die es im Verlaufe des Lebens zusätzlich negativ beeinflussen; unter Umständen kann es im Zeitverlauf zum Ausbruch affektiver Erkrankungen kommen.
Erbliche Prädispositionen und Affekterkrankungen aus Zell- und Organperspektive
Kausaltheoretisch führen multiple Veränderungen der Erbinformation auf Mikroebene in affektverarbeitenden Hirnarealen ggf. zu ungünstigen Zellstoffwechselveränderungen, aus denen nach außen gerichtete ungünstige exogene Zellaktivitäten resultieren können (→ ausführlich in Abschnitt 1.2).
Je nachdem, welche Enzym‑, Protein‑ oder ncRNA‑Codes betroffen sind, wirken sich Veränderungen auf einzelne oder mehrere, ggf. auch alle Prozessbereiche einer Zelle negativ aus. Veränderte ncRNA‑Codes haben aufgrund von Multiplikatoreffekten, die aus ihren komplexen Aufgaben bei der Durchführung und Modulation der Proteinbiosynthese resultieren, potentiell Auswirkungen auf viele oder sogar sämtliche Zellstoffwechselprozesse.
Mittel‑ bis langfristig können diese Prozesse zu ungünstigen Veränderungen hinsichtlich Neuronenanzahl und ‑vernetzung (→ 3‑Stufen‑Modell in Abschnitt 1.4) und auf Makroebene in affektrelevanten Hirnarealen mittel‑ bis langfristig zu ungünstigen strukturellen Veränderungen ‑ beispielsweise Gewebeschrumpfungen ‑ führen (→ ausführlich in Abschnitt 1.3).
Warum ncRNA-Codes bei DNA-Sequenzanalysen unberücksichtigt bleiben
Die Entdeckung kurzkettiger ncRNA, die an der Proteinbiosynthese entscheidend mitwirken, erfolgte in der gleichen Zeitperiode, in der auch die Analyse des menschlichen Genoms erstmals erfolgreich durchgeführt wurde, die 1990 begonnen hatte und deren erste Stufe im Jahre 2001 abgeschlossen wurde.
Aufgrund dieser Aktivitäten wurde Ende der 1990er Jahre erkannt, dass nur 2% des Genoms Peptide, also Enzyme oder Proteine, codieren. Es mehrten sich die Hinweise, dass ein großer Teil der restlichen Codes ncRNA-Moleküle betrifft. Bis dahin galt die Erbinformation nämlich ausschließlich als Informationsträger für Peptidcodes. Diese Sicht ist aufgrund von Entdeckungen zahlreicher ncRNA-Moleküle und der Gensequenzanalyse nun nicht mehr haltbar.
Auch wenn die Erforschung der Bedeutung kurzkettiger ncRNA-Moleküle in den nächsten Jahren bzw. Jahrzehnten forciert wird, besteht die Gefahr, dass sich ein notwendiger Paradigmenwechsel in den Wissenschaften nur sehr langsam vollzieht.
Das Thema wird in Abschnitt 4.10, der ganz der Bedeutung verschiedener ncRNA-Moleküle gewidmet ist, noch intensiver erörtert.
Ergebnisse empirischer Studien und genetischer Analysen
Die Ergebnisse von Familien- und Zwillingsstudien weisen überwiegend darauf hin, dass bei sämtlichen affektiven Erkrankungen polygenetische Prädispositionen potentiell eine Rolle spielen.
Viele Studien deuten darauf hin, dass die Bipolare Störung stärker im Zusammenhang mit genetischen Faktoren zu stehen scheint als die unipolare Depression oder die Manie.
Genanalysen, die erst seit kurzer Zeit möglich sind, ergaben noch keine belastbaren Ergebnisse über eine verstärkte Beteiligung einzelner Verdachts- bzw. Kandidatengene an Affektstörungen im Zusammenhang mit polygenetischen Prädispositionen.
Eine höhere spezielle Relevanz der Erbinformation bei Affektstörungen?
Die allgemeine zellphysiologische Relevanz der ursprünglichen Erbinformationen in Relation zu den anderen Kausalfaktoren wurde im dritten Kapitel als mittelgradig eingeschätzt (→ Abschnitt 3.4.2).
Diese Bewertung wird durch verschiedene direkt auf Affektstörungen bezogenen Modelle und vor allem durch die Ergebnisse emprischer Familien- und Zwillingsstudien zunächst bestätigt. Auf Basis dieser Informationen ist es darüber hinaus gerechtfertigt, die Relevanz der ursprünglichen Erbinformation speziell bezüglich der Bipolaren Störung höher als die von unipolarer Depression oder Manie zu bewerten.
4.8 Glukosemangel (Hypoglykämie) und Affektstörungen ▲
Kohlenhydrate werden hauptsächlich als Mehrfach- oder Zweifachzucker mit der Nahrung aufgenommen, beispielsweise in Form von Stärke, Milchzucker, Rohrzucker oder Rübenzucker. Zur Verwertung als Energiequelle muss der Körper sie in Traubenzucker, einen Einfachzucker, aufspalten. Traubenzucker wird auch als Dextrose oder Glukose bezeichnet und ist der Hauptenergielieferant aller Zellen. Glukose kann auch in der Nahrung direkt enthalten sein. In diesem Falle ist keine Umwandlung notwendig, und der Traubenzucker wird schnell ins Blut aufgenommen.
Glukose ist der ausschließliche Energielieferant der Neuronen von Gehirn und Rückenmark, da Nervenzellen im Gegensatz zu den Körperzellen Fette nicht direkt als Energiequellen nutzen können. Dadurch ist das Gehirn von einer regelmäßigen und ausreichenden Glukosezufuhr besonders abhängig. Nur in der Ausnahmesituation während des Hungerstoffwechsels nutzen Neuronen andere Substanzen zur Energiegewinnung und senken dadurch ihren Glukosebedarf um fast 70%. Für die Energieversorgung anderer Zellen des Gehirns, beispielsweise Blutgefäß- oder Bindegewebezellen, gilt das nicht, ebenso für Gliazellen; diese Zellen nutzen auch Fette für ihre Energieversorgung.
Glukose wird - wie auch Aminosäuren - aktiv durch die Blut-Hirn-Schranke zu den Nervenzellen des Gehirns transportiert, während beispielsweise der ebenfalls für die Energieversorgung wichtige Sauerstoff an dieser Schranke vorbei über kleine und kleinste arterielle Blutgefäße das Gehirn passiv durch Diffusion erreicht.
Eine optimale Blutzuckerverlaufskurve
Aufgrund des ständigen Energiebedarfs muss der Körper immer über ausreichend Glukose verfügen, sowohl bei Tag als auch während der Nacht. Da es dem Menschen unmöglich ist, die Glukoseverfügbarkeit durch die Kohlenhydratzufuhr exakt zu steuern, übernehmen körpereigene autonome Mess- und Regelkreise diese wichtige Aufgabe und sorgen für eine ausreichende Glukoseversorgung.
Mangels einer Energiealternative zur Glukose ist das Gehirn damit besonders von der Funktionsfähigkeit dieser körpereigenen Mess- und Regelkreise abhängig. Im Mittelpunkt steht dabei der Blutzuckerwert, denn Glukose wird über den Blutkreislauf zu den Zellen transportiert.
Durch Glukoseaufnahme, Glukoseverbrauch und die autonomen Mess- und Regelkreise entsteht eine spezifische Blutzuckerverlaufskurve. Ein optimaler Blutzuckerkurvenverlauf muss folgenden Kriterien genügen:
- Der Blutzuckeranstieg nach der Nahrungsaufnahme sollte zügig und stetig, das heißt ohne Schwankungen, bis zur Erreichung des Spitzenwertes erfolgen.
- Nach etwa einer Stunde ist der Spitzenwert idealerweise erreicht.
- Der Glukose-Spitzenwert muss mindestens 120 mg/dl, (6,7 mmol/l) besser 130 mg/dl (7,2 mmol/l), maximal jedoch 140 mg/dl (7,8 mmol/l) betragen.
- Der Glukosewert von 140 mg/dl (7,8 mmol/l) darf zu keiner Zeit überschritten werden.
- Nach dem Spitzenwert sinkt die Blutzuckerkurve langsam und stetig ohne Schwankungen wieder auf den Ausgangswert zurück oder nähert sich diesem. Diese Zeitspanne ist hauptsächlich von der Stärke der geistig-körperlichen Aktivität abhängig, auch die individuelle Höhe des Grundstoffwechsels spielt eine Rolle. Je stärker die Aktivitäten und je höher der Grundstoffwechsel, desto höher ist der Glukoseverbrauch und desto schneller sinkt die Blutzuckerkurve. Bei Ruhe beträgt dieser Zeitraum etwa drei bis fünf Stunden.
- Zu keiner Zeit darf beim kontiniuerlichen Absinken des Blutzuckerverlaufs der Ausgangswert bzw. Nüchternwert unterschritten werden.
- Im nüchternen Zustand muss der Blutzucker zwischen 80 und 99 mg/dl (4,4 bzw. 5,5 mmol/l) betragen, darf jedoch keinesfalls unter 70 mg/dl (3,89 mmol/l) absinken. Die Werte zwischen 71 und 80 mg/dl (3,94 bzw. 5,5 mmol/l) werden unterschiedlich bewertet und gelten somit als grenzwertig.
Graphik 5 zeigt einen Verlauf, der allen Kriterien einer optimalen Blutzuckerkurve entspricht.
GRAPHIK 5: EINE OPTIMAL VERLAUFENDE BLUTZUCKERKURVE
Graphik 5: Diese Blutzuckerkurve genügt den Anforderungen an einen optimalen Verlauf. Der Glukosewert darf niemals unter den Ausgangswert fallen, der zwischen 80 und 99 mg/dl (äquivalent 4.4 bis 5,5 mmol/l) liegen sollte. Der Anstieg nach der Nahrungsaufnahme erfolgt stetig und unauffällig. Er erreicht nach etwa einer Stunde seinen höchsten Wert, der idealerweise 130 mg/dl und maximal 140 mg/dl (7,2 bis 7,8 mmol/l) betragen sollte. Nachdem der höchste Wert erreicht ist, sinkt die Kurve genauso stetig und unauffällig in den nächsten drei Stunden wieder ab und nähert sich dem Ausgangswert (= Nüchternwert), ohne diesen zu unterschreiten. Bei starker körperlicher oder auch geistiger Aktivität sinkt die Kurve entsprechend schneller, ebenfalls bei hohem Grundumsatz.
4.8.1 Pathologische Blutzuckerwerte
Eine Blutzuckerkurve kann drei pathologische Charakteristika aufweisen:
- Hyperglykämie, d. h. zu hohe Blutzuckerwerte.
- Absolute Hypoglykämie, d. h. Blutzuckerwerte absolut zu niedrig.
- Relative Hypoglykämie, d. h. unstetiger, schwankender Blutzuckerkurvenverlauf oder zu schneller Kurvenabfall nach Erreichung des Spitzenwertes in Relation zur Stärke der körperlich-geistigen Aktivität.
Die Hyperglykämie ist das Hauptmerkmal verschiedener Diabetesformen. Ein solcher Zustand hat kurzfristig jedoch keinen nennenswerten Einfluss auf die Tätigkeit des Zentralnervensystems und Auswirkungen auf Affekte sind nicht bekannt. Erst bei sehr hohen Werten ab 600 bis 1.000 mg/dl (33,3 bzw. 55,5 mmol/l) sind Komplikationen in Form des Diabetischen Komas (Coma diabeticum) möglich.
Zu hohe Blutzuckerwerte spielen daher bei den Überlegungen hinsichtlich der Ursache von Affektstörungen keine Rolle. Hyperglykämie hat jedoch indirekt einen Einfluss, denn die Erkrankung führt mittel- bis langfristig zu pathologischen vaskulären Veränderungen, die auch eine schlechtere Gehirndurchblutung zur Folge haben können. Minderdurchblutungen in affektrelevanten Hirnregionen können Affektstörungen provozieren; dieses Thema wird im Teil B dieses Kapitels noch ausführlicher erörtert, denn es handelt sich um einen exogenen Einflussfaktor.
Ganz anders sieht es bei der Hypoglykämie aus, denn Glukosemangel kann auch kurzfristig erhebliche Auswirkungen auf den Organismus und insbesondere die Gehirntätigkeit haben, denn diese ist ja besonders von der Glukose abhängig. Grundsätzlich sind diabetische Hypoglykämie und nicht‑diabetische Hypoglykämie zu unterscheiden.
Diabetische Hypoglykämien resultieren immer aus Insulinüberdosierungen, die absolut zu niedrige Blutzuckerwerte zur Folge haben. Sie stellen das größte Problem bei der Diabetes-Therapie dar und können lebensgefährlich sein. Die absolute diabetische Hypoglykämie wird in Medizin bzw. Diabetologie daher sehr ernstgenommen.
Nicht‑diabetische Hypoglykämien sind demgegenüber unabhängig von einer Diabetes-Erkrankung. Die absolute Form betrifft ausschließlich Nicht-Diabetiker, während die relative Form auch Diabetiker betreffen kann, denn zu schnelle Kurvenabfälle oder Blutzuckerschwankungen führen auch unabhängig von der Blutzuckerhöhe ggf. zu hypoglykämischen Rekationen.
Nicht-diabetische Hypoglykämien sind relativ unbekannt, obwohl sie bei der Entstehung von Affektstörungen ‑ und auch einer Reihe anderen Erkrankungen ‑ eine erhebliche Rolle spielen. Sie werden von der Medizin völlig zu Unrecht unterschätzt oder ignoriert. Ein nicht-diabetischer hypoglykämischer Blutzuckerverlauf kann eine ganze Reihe affektiver und nicht-affektiver Symptome hervorrufen, beispielsweise Unruhezustände, Verwirrung, Stimmungstiefs oder Stimmungschwankungen.
Etwas Terminologie
Der US-amerikanisch-österreichische Neurologe Josef Wilder vewendete im Jahre 1930 erstmals den Begriff Spontanhypoglykämie, um die nicht-diabetische Form von der diabetischen Hypoglykämie abzugrenzen. Auch der Internist Friedrich Meythaler verwendete seit den 1940er Jahren diese Bezeichnung.
Statt dieser veralteten Terminologie werden hier folgende Bezeichnungen verwendet:
- Hypoglykämie
- hypoglykämischer Blutzuckerverlauf
- (nicht-diabetisches) Hypoglykämie-Syndrom
Der Begriff Hypoglykämie ist dabei vereinfachend die alternative Bezeichung für einen nicht‑diabetischen hypoglykämischen Blutzuckerverlauf. Nicht‑diabetische Hypoglykämie und hypoglykämischer Blutzuckerverlauf bzw. Hypoglykämie werden daher hier synonym verwendet.
Hypoglykämie bezeichnet damit gleichzeitig verschiedene Primärsymptome; neben einem absoluten Glukosemangel schließt das auch den relativen Glukosemangel („Relative Hypoglykämie“) ein, d. h. einen unsteten Blutzuckerkurvenverlauf oder einen zu schnellen Kurvenabfall.
Der Begriff „Relative Hypoglykämie“ wird ebenfalls weitgehend vermieden. Schwankende oder zu schnell sinkende Blutzuckerwerte sind letztlich Symptome einer (nicht‑diabetischen) Hypoglykämie.
Der Begriff des (nicht‑diabetischen) Hypoglykämie-Syndroms umfasst demgegenüber das gesamte Krankheitsbild, zu dem vor allem die Sekundärsymptome gehören. Die Bezeichnung „Syndrom“ weist dabei auf eine große Vielfalt hin, die sowohl affektive als auch nicht-affektive Symptome umfasst.
4.8.2 Blutzuckerkurvenverlauf bei Hypoglykämie
Der Verlauf einer Blutzuckerkurve bei Hypoglykämie weicht in mindestens einem Merkmal vom optimalen Kurvenverlauf in Graphik 5 ab:
- Nüchternwert unter 80 mg/dl, mindestens jedoch unter 70 mg/dl (entsprechend 4,4 bzw. 3,9 mmol/l).
- Unmittelbar nach der Nahrungsaufnahme sinkt der Blutzucker unter den Nüchternwert.
- Der Anstieg nach der Nahrungsaufnahme verläuft bis zum Spitzenwert unstetig, das heißt mit Schwankungen.
- Der Spitzenwert wird deutlich unter einer Stunde zu schnell erreicht.
- Der Spitzenwert liegt unter 120 mg/dl (6,7 mmol/l).
- Der Abfall der Kurve nach Erreichen des Spitzenwerts verläuft unstetig, das heißt mit Schwankungen.
- Der Abfall der Kurve nach Erreichen des Spitzenwerts verläuft zu schnell. Der Ausgangswert oder dessen Näherungswert ist schon ca. zwei Stunden nach Nahrungsaufnahme im Zustand körperlicher Ruhe oder sogar früher wieder erreicht. Hier sind die Aktivitäten der betroffenen Person zu berücksichtigen (→ Anmerkungen zu Graphik 5).
- Der Zuckerwert sinkt im gesamten Verlauf ein oder sogar mehrfach unter den Nüchternwert.
Grenzwertproblematik und Whipple-Trias
Heutzutage werden Hypoglykämien jedweder Art überwiegend erst diagnostiziert ‑ wenn überhaupt ‑ ab einem Blutzuckerspiegel von unter 50 ml/dl (2,8 mmol/l).
Vor allem für die Diagnose der nicht-diabetischen Hypoglykämie ist ein Grenzwert von 50 mg/dl (2,8 mmol/l) viel zu niedrig und ungeeignet. Aus der Praxis weiß man, dass schon Werte ab unter 80 mg/dl (4,4 mmol/l) zu einer hypoglykämischen Symptomatik führen können (Quelle: Erich Grafe, Ernährungs- und Stoffwechselkrankeiten und ihre Behandlung, Springer-Verlag, Berlin/Göttingen/Heidelberg 1958, 2. Auflage).
Der niedrige Grenzwert ist falsch und gefährlich. Patienten, deren Werte zwischen 51 und 79 mg/dl (2,83 bzw. 4,38 mmol/l) liegen, fallen trotz typischer Symptome durch dieses viel zu grobe Diagnose-Raster.
Dazu kommt, dass schwankende oder zu steil abfallende Blutzuckerkurven ‑ also die Kennzeichen einer relativen Hypoglykämie ‑ aus Unkenntnis überhaupt nicht berücksichtigt werden, obwohl auch Patienten mit einem Nüchternzucker zwischen 80 und 99 mg/dl (4,4 bzw. 5,5 mmol/l) oder sogar Diabetiker mit einem viel höheren Blutzuckerwert dadurch von Hypoglykämie betroffen sein können.
Der niedrige Grenzwert ist Teil der Whipple‑Trias, die ursprünglich für die Diagnose eines Insulinoms von dem im Jahre 1963 verstorbenen US-amerikanischen Chirurgen Allen O. Whipple beschrieben wurden. Die Whipple‑Trias werden heutzutage im Allgemeinen für die Diagnose sämtlicher Hypoglykämien herangezogen ‑ trotz der Verschiedenartigkeit ihrer Ursachen.
Die drei Whipple-Kriterien lauten:
- Blutzuckerwerte unter 50 mg/dl bzw. 2,8 mmol/l (alternativ werden manchmal sogar nur 45 mg/dl bzw. 2,5 mmol/l genannt)
- Hypoglykämie-assoziierte Symptomatik
- Besserung/Verschwinden der Symptome nach Verabreichung einer Glukoselösung
Aber auch die Whipple-Kriterien Nr. 2 und 3 sind für die Diagnose einer nicht-diabetischen Hypoglykämie ungeeignet:
- Affektive Symptome gelten vielen gerade nicht als hypoglykämie-assoziiert, so dass ein Zusammenhang unerkannt bleibt. Mit einer hypoglykämie-assoziierten Symptomatik nach Whipple werden ausschließlich nicht‑affektive Symptome, wie beispielsweise Zittern, Heißhunger, Tachykardie, Schwindel und Müdigkeit etc., verbunden.
- Bei nicht-diabetischen Hypoglykämie-Patienten führt die Verabreichung von Zuckerlösungen meist zu einer Verschlimmerung ihrer Symptome. Durch die Verwendung von Lösungen mit Einfach- oder Zweifachzuckern wird nämlich häufig eine überschießende Insulinproduktion provoziert, so dass der Blutzucker weiter sinkt oder es zu Blutzuckerschwankungen kommen kann.
An dem zu niedrigen Grenzwert ist nicht nur A. O. Whipple schuld. Es liegt auch an den Aktivitäten des bekannten US-amerikanischen Endokrinologen Jerome W. Conn, der 1955 erstmalig den primären Hyperaldosteronismus beschrieb, sich schon in den 1930er Jahren auch intensiv mit der nicht-diabetischen Hypoglykämie beschäftigte, leider jedoch erst Blutzuckerwerte unter 40 mg/dl (2,2mmol/l) als pathologisch einstufte. Diese Auffassung hat sich aufgrund Conns hoher Reputation leider weit verbreitet ‑ mit entsprechend negativen Folgen bis in die heutige Zeit. Mit einer gewissen Wahrscheinlichkeit hat sich auch Whipple an Conns Werten orientiert, denn sein Diagnoseinstrument entwickelte er etwa Mitte der 1930er Jahre, also nachdem Conn seine Ergebnisse veröffentlicht hatte.
4.8.3 Neurologisch-psychiatrische Symptomatik des Hypoglykämie-Syndroms und Ernährung
Das Gehirn übernimmt neben seiner Zuständigkeit für kognitive und emotionale Prozesse bei fast allen körperlichen Vorgängen wichtige Funktionen. Ist es aufgrund eines suboptimalen Glukoseangebotes in seiner Tätigkeit gestört, verwundert es nicht, dass eine großen Fülle psychischer, neurologischer und körperlicher Symptome auftreten können (→ Abschnitt 1.5 mit den Hinweisen auf psychosomatische Zusammenhänge).
Für vom Hypoglykämie-Syndrom Betroffene stellt das ein ernstes Problem dar, da trotz des breiten Symptomspektrums und ihrem hohen Leidensdruck die Ursachen aus den genannten Gründen häufig nicht erkannt werden.
Aber selbst wenn ein Hypoglykämie‑Syndrom frühzeitig in Betracht gezogen wird, erschwert die Grenzwertproblematik die Diagnose, denn diese wird in der Regel erst unter einem Nüchternglukosewert von 50 mg/dl (2,8 mmol/l) gestellt. Für längerfristige Kurvenverläufe interessiert sich in der Regel auch niemand. Ein Patient mit ansonsten unauffälligen Blutwerten, dessen Glukosespiegel sich zwischen 50 ‑ 79 mg/dl (2,8 ‑ 4,38 mmol/l) bewegt, löst wegen seiner zahlreichen und massiven Symptome bei Ärzten oder Therapeuten meist nur Kopfschütteln aus. Oft folgt dann ein „Ärzte‑Hopping“ mit vielen unkoordiniert‑ergebnislosen Untersuchungen und Behandlungen, ohne dass sich an der Situation etwas ändert.
Darüber hinaus wird den Patienten, oft schon unmittelbar nachdem sie ihr umfangreiches Symptomspektrum geschildert haben, spätestens aber nach jahrelangen und erfolglosen Ursachenforschungen und Behandlungsversuchen, Hypochondrie unterstellt, oder es erfolgt das Abschieben in die „Psycho-Ecke“ mit der Flucht in wenig hilfreiche psychotherapeutische Therapien oder die Verordnung von Psychopharmaka.
Nur wenn der Patient das Glück hat, an einen sachkundigen Therapeuten zu geraten, besteht die Chance einer korrekten Diagnose.
In seinem ‑ derzeit leider vergriffenen ‑ Buch zählt der Autor Michael Martin verschiedene Symptome auf (Quelle: Michael Martin, Das Hypoglykämie-Syndrom ‑ Ursachen, Symptome, Diagnose und Therapie der «anderen Zuckerkrankheit», Ralf Reglin Verlag, 1. Auflage, Köln 1996), wobei viele von ihnen Affekte, Antrieb und neurologische Auffälligkeiten betreffen, die in der Aufzählung hervorgehoben sind:
- Aufmerksamkeitsdefizite und Konzentrationsstörungen
- Aggressivität
- Chronische Darmstörungen
- Ekzeme
- Entschlusslosigkeit
- Müdigkeit und Erschöpfung
- Heißhungerattacken
- Kopfschmerzen bzw. Migräne
- Muskelkrämpfe
- Krampfanfälle bzw. Epilepsie
- Phobien
- Psychosen
- Ruhelosigkeit
- Schlaflosigkeit
- Schwindel
- Sehstörungen
- Sprachstörungen
- Stimmungsschwankungen
- Stimmungstiefs
- Tachykardie oder Bradykardie
- Tremor
- Übelkeit und Erbrechen
- Überaktivität bzw. Hypomanie
- Unruhezustände
- Verwirrung
- Zittern
Einen allgemeingültigen Zusammenhang zwischen exakten Grenzwerten und Symptomen gibt es nicht, Betroffene können höchst unterschiedlich reagieren. Es gibt Patienten, die mit bestimmten Blutzuckerwerten noch keine Probleme haben, die bei anderen aber schon mit einer massiven Symptomatik verbunden sind. Die Werte sind daher eher als Richtwerte aufzufassen. Aus kausaltheoretischer Sicht betrachtet ist dieses Phänomen leicht zu begründen (→ Erklärung unten).
Ernährungsabhängige Hinweise auf ein Hypoglykämie-Syndrom
Da Ernährung einen erheblichen Anteil an der Blutzuckerentwicklung hat, ist es nicht verwunderlich, dass sich erste Verdachtsmomente im Zusammenhang mit der Ernährung ergeben und Symptome ständig oder gelegentlich...
- unmittelbar nach dem Essen oder währenddessen auftreten oder bestehende Symptome sich verstärken,
- nach dem Verzehr komplexer Kohlenhydrate, beispielsweise Getreide, Hirse, Buchweizen, Reis, Kartoffeln etc. auftreten oder sich verstärken,
- nach dem Verzehr von Einfach‑ oder Zweifachzuckern, beispielsweise Traubenzucker, Rohrzucker oder Rübenzucker/Haushaltszucker, auftreten, sich verstärken und im Vergleich mit komplexen Kohlenhydraten eventuell heftiger sind,
- längere Zeit nach dem Essen auftreten oder sich verstärken, beispielsweise ab drei oder mehr Stunden, oder
- während längerer Fastenperioden auftreten.
- Gelegentliche oder häufige Heißhungerattacken oder ein ständig hoher Konsum von Süßigkeiten sind ebenfalls sehr verdächtig.
- Ebenfalls besteht ein Verdacht, wenn der Appetit auf Süßigkeiten auch nach Eintreten eines Sättigungsgefühls, beispielsweise nach einer ausreichend großen herzhaften Mahlzeit, weiter fortbesteht.
Exkurs: Die Selfish-Brain-Theorie oder das „egoistische Gehirn“
Obwohl sich ein direkter Zusammenhang zwischen Hypoglykämie und verschiedenen Symptomatiken aufdrängt, wird auch die Meinung vertreten, das Gehirn selber bzw. der Organismus müsse über Notmechanismen verfügen, die eine ausreichende Versorgung der Nervenzellen mit Glukose immer sicherstellen. Daher wären selbst kurz- bis mittelfristig zu geringe Blutzuckerwerte unerheblich und könnten weder für Affektstörungen noch für nicht-affektive Symptome verantwortlich sein.
Seit einigen Jahren wird an dieser sogenannten Selfish-Brain-Theorie geforscht, wonach sich das Gehirn immer eigennützig verhält und dafür sorgt, Glukose auch auf Kosten peripherer Organe zu bekommen. Bis heute gibt es allerdings keinen Beweis oder eine Vorstellung, wie der dazugehörige Mechanismus aussehen könnte. Selbst bei Zuftreffen der Selfish-Brain-Theorie würde sie nichts darüber aussagen, ob der Glukoseanteil, den sich das egoistische Gehirn sichert, tatsächlich für eine 100prozentige Funktionsfähigkeit ausreicht oder nur eine Basisfunktion garantiert, und was das für Affekte bedeutet. Die Postulate der Selfish-Brain-Theorie nützen auch nichts bei einer Einschätzung, ob das Gehirn mit schwankenden oder schnell sinkenden Blutzuckerverläufen zurechtkommt oder nicht.
Gerade die Tatsache affektiver und nicht-affektiver Symptome in Verbindung mit Hypoglykämie widerlegt die Selfish-Brain-Theorie.
4.8.4 Bestimmungsfaktoren des Blutzuckers
Drei Hauptfaktoren bestimmen die Glukoseversorgung bzw. Blutzuckerhöhe:
- Nahrungsaufnahme,
- Energieverbrauch und die
- Blutzuckerregulation.
Dabei spielen eine Reihe von Einflüssen eine Rolle, insbesondere...
- der Kohlenhydrateanteil in der Nahrung,
- die Zusammensetzung des Kohlenhydrateanteils (komplexe vs. kurzkettige Kohlenhydrate),
- der Auf- oder Abbau körpereigener Glukosevorräte,
- die Verdauungstätigkeit des Dünndarms einschließlich der Sekretion des Dünndarmhormons GLP-1,
- die Funktionsfähigkeit und das Zusammenspiel der Blutzuckerregelkreise,
- die Leistungsfähigkeit von Leber, Nieren und Pankreas,
- die Stressregulation,
- die Auswirkungen körperlicher und geistiger Tätigkeit,
- die Höhe des Grundumsatzes,
- der Umgang mit Alkohol, zum Beispiel Alkoholmissbrauch und
- eine bestehende Schwangerschaft.
Neueste Forschungen weisen darauf hin, dass auch Gliazellen, in diesem Falle Astrozyten, den Glukosetransport in die Nervenzellen steuern könnten (Quelle: Pharmazeutische Zeitung online, Gliazellen regulieren aktiven Zuckertransport ins Gehirn, Avoxa ‑ Mediengruppe Deutscher Apotheker GmbH, 12.8.2016, http://www.pharmazeutische-zeitung.de/...). Danach wären funktionell gestörte Gliazellen in der Lage, die Zuckerversorgung des Gehirns insgesamt zu gefährden oder auch eine auf bestimmte Bereiche des Gehirns beschränkte lokale Hypoglykämie zu verursachen. Da es darüber aber noch zu wenig Erkenntnisse gibt, soll das Thema hier nicht weiter diskutiert werden.
Ursachen eines steigenden bzw. fallenden Blutzuckerspiegels
Folgende Ereignisse führen zu steigenden Blutzuckerwerten:
- Aufnahme verschiedener Einfachzucker im Dünndarm
Verschiedene und verschieden lange Zuckermolekülketten zerlegt der Verdauungsprozess in die Einfachzucker Glukose (Traubenzucker), Fruktose (Fruchtzucker) und Galaktose (Schleimzucker). Fruktose und Galaktose müssen in der Leber noch in Glukose umgewandelt werden, um als Energieträger nutzbar zu sein.
- Umwandlung des Speicherzuckers (Glucogenese)
Im Falle eines Nahrungsstopps werden Glykogenvorräte in Leber und Muskulatur zu Glukose umgewandelt. Der Speicherzuckerabbau in der Leber und die Abgabe von Glukose in den Blutkreislauf sorgen dafür, dass der Blutzuckerwert noch für ein bis zwei Tage ausreichend hoch bleiben kann, während die Muskulatur Glucogenese nur für ihren Eigenbedarf betreibt und keine Glukose ins Blut abgibt.
Aber nicht nur beim Nahrungsstopp wird die Glucogenese aktiviert, auch während eines zu schnellen Blutzuckerabfalls ist sie Teil der Strategie, den Blutzuckerwert kurzfristig zu erhöhen.
- Umwandlung der Aminosäuren zu Glukose (Gluconeogenese)
Bei einer länger andauernden Kohlenhydratmangelernährung wird ein Teil der Aminosäuren aus der Nahrung in Leber und Nieren zu Glukose umgewandelt, falls diese genügend Proteine enthält. Die Gluconeogenese sorgt aber auch bei längeren Fasten- oder Hungerperioden für einen ausreichenden Blutzuckerwert, beispielsweise wenn die Speicherzuckervorräte nach zwei Tagen aufgebraucht sind und der Nahrungsstopp anhält. Dazu bedient sich der Körper der Aminosäuren der Skelettmuskulatur, die dadurch abgebaut wird.
Die Gluconeogenese wird auch bei kurzfristig sehr hohem Energiebedarf aktiviert, bei dem Nahrungsglukose und Glucogenese nicht ausreichend Energie liefern.
- Steigerung der Sympathikusaktivitäten (Stressregulation)
Der Ausstoß von Adrenalin, Noradrenalin oder Cortisol steigert kurzfristig sowohl Glucogenese als auch Gluconeogenese, so dass dringend benötigte Energie schnell zur Verfügung steht.
- Vermehrte Ausschüttung von Schilddrüsenhormonen (Erhöhung des Grundumsatzes)
Eine Steigerung der beiden Schilddrüsenhormone T3 und T4 erhöht den Stoffwechselgrundumsatz auf Leistungsumsatz, was ebenfalls zur Aktivierung von Glucogenese und Gluconeogenese führt, falls die Nahrung nicht genügend Kohlenhydrate enthält.
- Insulinmangel oder Insulinresistenz
Insulin ist notwendig, damit Glukose aus dem Blut in die Körperzellen gelangt, um dort verstoffwechselt werden zu können. Diabetiker produzieren zu wenig oder gar kein Insulin. Die Folge ist, dass Zellen nicht ausreichend mit Glukose versorgt werden können und sich Glukose im Blut anhäuft und dort zirkuliert.
Insulinmangel erhöht daher den Blutzuckerspiegel und kann zu abnorm hohen Werten führen. Ohne therapeutische Gegensteuerung in Form einer Insulintherapie bliebe der Zuckerwert im Blut stark überhöht, während die Zellen dabei „verhungern“.
Das Gleiche gilt für den Fall insulinresistenter Körperzellen, denn dann wird Glukose trotz ausreichender Insulinmenge nicht in die Körperzellen transportiert und der Blutzucker bleibt ebenfalls hoch.
Folgende Ereignisse führen zu sinkenden Blutzuckerwerten:
- Nahrungsstopp
Wird keine Nahrung zugeführt, sinkt der Blutzuckerwert kurzfristig, idealerweise aber nicht unter den Nüchternzuckerwert. Dafür sorgen ‑ bei intakten Mess‑ und Regelkreisen ‑ Glucogenese und/oder Gluconeogenese.
- Insulinausschüttung
Durch Insulin kann Glukose aus dem Blut in die Körperzellen gelangen, worauf der Blutzuckerspiegel sinkt. Das gelingt allerdings nur, wenn Zellen nicht insulinresistent sind.
- Sämtliche Körper- bzw. Zellaktivitäten einschließlich Glycogenese
Alle Organaktivitäten führen zu einem Glukoseabbau zwecks Energiegewinnung. Das gilt vor allem für die energiehungrigen Nervenzellen des Gehirns. Da Zellen verbrauchte Glukose kontinuierlich aus dem Blut durch neue Glukose ersetzen, ist ein sinkender Blutzuckerspiegel die Folge.
Bei Leber oder Muskulatur zählen zur Organaktivität auch die Umwandlung von Glukose in den als Glykogen bezeichneten Speicherzucker. Dieser als Glycogenese bezeichnete Prozess wirkt ebenfalls blutzuckersenkend und ist die Voraussetzung für die Glucogenese.
- Alkohol und Alkoholabusus
Durch Alkoholkonsum sind Leberfunktionen oftmals beeinträchtigt. So führt der Alkoholabbau aufgrund seiner Vorrangstellung dazu, dass die Prozesse Glycogenese, Glucogenese oder Gluconeogenese in den Hintergrund geraten und nicht genügend Glukosereserven aktiviert werden können.
Bei alkoholbedingter Leberschädigung sind diese Vorgänge oft grundsätzlich gestört. Die bei Alkoholikern häufig vorkommende und gefährliche Unterernährung führt darüber hinaus zu einem noch weiter reduzierten Einbau von Speicherzucker (Glycogenese) in Leber und Muskulatur.
- Schwangerschaft
Durch den zusätzlichen Energiebedarf des Fötus wird dem mütterlichen Stoffwechsel vermehrt Glukose entzogen.
4.8.5 Zwei Prinzipien der Blutzuckerregulierung
Der Blutzuckerspiegel wird durch zwei grundsätzlich verschiedene Mess‑ und Steuerungskreise reguliert:
- Die Pankreasrückkopplung ist mit vier Subregelkreisen hauptsächlich für die Verwertung und Regulierung der Nahrungsglukose zuständig.
- Die Rückkopplung zum Hypothalamus mobilisiert mit Hilfe dreier Subregelkreise vor allem den Glukosebedarf bei Aktivitäten und Stress.
Alle Regelkreise sind funktional miteinander verbunden und daher nicht exakt voneinder zu trennen. Das liegt in erster Linie natürlich am Blutzucker als gemeinsames Regelungsobjekt, aber auch an übergeordneten Funktionen von Hypothalamus und Hypophyse bei allen Regelkreisen.
(1) Blutzuckerregulation durch Pankreas-Rückkopplung
Die Rückkopplung erfolgt über die Langerhans-Inselzellen des Pankreas, von denen Typ A (Alpha) und Typ B (Beta) unterschieden werden.
Nur die B-Inselzellen verfügen über Glukoserezeptoren, die als Messfühler den Blutzucker ständig kontrollieren. Sie übermitteln ihre Werte an die Regelbereiche der A- und B-Inselzellen.
Diese Messfühler vergleichen ständig die Ist- und Sollwerte der Blutzuckerkonzentration, die ihnen vom Hypothalamus als übergeordnete Zentrale vorgegeben werden. Die Informationen zur Sollwertbestimmung bekommt der Hypothalamus u. a. vom GLP‑1‑Hormon des Dünndarms. Der Hypothalamus nutzt für die Glukosesollwertübertragung an die B‑Inselzellen die Nervenbahnen des Sympathikus bzw. Parasympathikus, was eine Ausnahme darstellt, denn alle anderen Informationen werden hormonell via Blutbahn übertragen.
Soll-Ist-Abweichungen lösen in den Langerhanszellen eine Veränderung der Hormonproduktion aus. Die Langerhanszellen Typ A reagieren auf einen zu niedrigen Blutzuckerwert und sezernieren Glukagon. Glukagon mobilisiert die Glukosevorräte im Körper, so dass es zu einem Blutzuckeranstieg kommt. Langerhanszellen Typ B sezernieren bei hohen Blutzuckerwerte Insulin. Insulin ist hauptsächlich dazu da, insulinabhängigen Zellen die Glukoseverwertung zu ermöglichen. Durch Insulin gelangt die Glukose in die Körperzellen und ist dort als Energieträger nutzbar. Denentsprechend sinkt die Glukosekonzentration im Blut nach einem Insulinausstoß.
Nervenzellen stellen eine Ausnahme dar, da sie Glukose ohne Insulin verwerten, das heißt sie nehmen Glukose insulinunabhänging auf. Bei einem erhöhten Insulinspiegel erhalten insulinabhängige Körperzellen daher vergleichsweise mehr Glukose, wodurch es für Nervenzellen zu einem Engpass kommen kann.
Durch die gegenläufigen Aktivitäten der Antagonisten Glukagon und Insulin bleibt der Blutzuckerspiegel im Idealfall im Gleichgewicht.
Während eines Blutzuckerabfalls führt Glukagon zu folgenden Aktivitäten:
- Glucogenese: Umwandlung von Speicherzucker in Glukose
Glucogenese (synonym Glycogenolyse) findet in Leber und Muskulatur statt. Durch Umwandlung von zuvor gespeichertem Glykogen in Glukose und Abgabe an den Blutkreislauf stellt die Leber die Energieversorgung im Falle eines Glukoseengpasses für alle Zellen, außer den Muskelzellen, sicher.
Die Glukosevorräte reichen ‑ je nach der Intensivität der Aktivitäten ‑ für ein bis maximal zwei Tage aus. Die Glucogenese dient damit als ein schneller Überbrückungsmechanismus, der für längere Hungerperioden jedoch ungeeignet ist.
Auch in der Muskulatur bewirkt Glukagon die Glucogenese. Muskeln bauen ihre Speichervorräte jedoch nur für den Eigenbedarf ab und teilen sie nicht mit anderen Organen. Die Leberkapazitäten reichen nämlich nicht aus, auch noch die gesamten Körpermuskulatur mit Glukose zu versorgen. Wahrscheinlich benötigen die Muskeln Glukose auch schneller, und der Umweg über ein anderes Organ würde die Sache erheblich verlangsamen. Im Regelkreis spielt die Glucogenese der Muskulatur daher nur eine indirekte Rolle.
- Gluconeogenese: Umwandlung von Aminosäuren in Glukose
Gluconeogenese bezeichnet die Fähigkeit des Körpers, Zucker aus Nicht-Kohlenhydraten, hauptsächlich Aminosäuren, selber herzustellen. Die Orte, in denen Gluconeogenese stattfindet, sind Leber und Nierenrinde. Der Anteil der Nierenrinde an diesem Prozess wurde lange Zeit unterschätzt. Auf der Skizze in Abbildung 28 ist aus Gründen der Übersichtlichkeit nur die Leber dargestellt.
Nach einem Blutzuckeranstieg mobilisiert Insulin folgende Aktivitäten:
- Glycolyse: Energiegewinnung aus Glukose
Glycolyse findet in allen Zellen statt und bezeichnet den elementaren Energieversorgungsprozess. Ohne Glykolyse sind keine Lebensaktivitäten möglich. Insulin transportiert die Glukose in die insulinabhängigen Körperzellen (die Nervenzellen benötigen kein Insulin).
- Glycogenese: Umwandlung von Glukose in Speicherzucker
Glycogenese geht der Glucogenese voraus. Leber und Muskulatur wandeln für Notzeiten Glukose in den als Glykogen bezeichneten Speicherzucker um. Der gesamte Speicherzucker des Körpers befindet sich zu einem Drittel in der Leber und zu zwei Dritteln in der Muskulatur.
Dünndarmaktivitäten zählen nicht zu den unmittelbaren Bestandteilen des Glukose-Regelkreises, denn durch sie werden keine direkten Informationen über die Blutzuckerkonzentration ausgetauscht. Dünndarmaktivitäten stehen jedoch in einem mittelbaren Zusammenhang mit der Blutzuckerregulierung, denn erstens erhält der Körper Glukose überwiegend durch die Aufnahme über den Dünndarm und zweitens sezerniert der Dünndarm das Hormon GLP‑1, welches dem Hypothalamus wichtige Informationen für die Berechnung der Sollwertvorgabe der Blutzuckerhöhe liefert, mit denen wiederum die Messbereiche der Langerhanszellen Typ B beeinflusst werden.
Enthält der Nahrungsbrei Kohlenhydrate, sendet der Dünndarm mittels GLP‑1 darüber hinaus Signale an die Regelkreise beider Langerhanszelltypen. Die B‑Zellen werden dadurch zur Insulinproduktion stimuliert, die A‑Zellen drosseln daraufhin ihre Glukagonsynthese.
Weiterhin verfügt das Sättigungszentrum im Hypothalamus über GLP‑1‑Rezeptoren. Das dort entstehende Sättigungsgefühl führt zu einem Stopp der Nahrungsaufnahme und damit einer Drosselung der Glukoseaufnahme.
Die Regulation von Hunger und Sättigung wird noch nicht vollständig verstanden, und es existieren verschiedene Theorien über die Regulationsmechanismen. So geht die glukostatische Theorie vom naheliegenden Gedanken aus, dass das Hunger-Sättigungs-Zentrum des Hypothalamus auch direkt durch die Konzentration der Glukose im Blut stimuliert wird. So reagieren beispielsweise Menschen, die ausschließlich über Infusionen ernährt werden, während und nach der Verabreichung glukosehaltiger Infusionslösungen mit einem Sättigungsgefühl.
Entscheidend ist, dass der Hypothalamus als oberste Instanz des Blutzuckerregelkreises fungiert, indem er den Glukose‑Sollwert vorgibt.
ABBILDUNG 28: BLUTZUCKERREGULATION MIT PANKREAS-RÜCKKOPPLUNG
Abbildung 28: Am Regelkreis beteiligt sind die Langerhans-Inselzellen des Pankreas als für die Messung und Regelung verantwortliche Instanz, welche die Blutzuckerkonzentration direkt beeinflussen. Die Sollwertvorgabe stammt vom Hypothalamus des Zentralnervensystems. Hypothalamus, Langerhanszellen, Leber und die Nieren(-rinde) sorgen in einem komplexen kybernetischen System für einen Ausgleich des Blutzuckers. Die Muskelzellen sind daran nur mit Glukoseverbrauch und Glycogenese indirekt beteiligt, da sie die Glucogenese ausschließlich für den Eigenbedarf betreiben, das heißt ihre aus Speicherzucker gewonnene Glukose nicht in den Blutkreis abgeben und somit nicht mit anderen Organen teilen. Der Dünndarm beeinflusst den Regelkreis durch sein Hormon GLP‑1. Um die Zeichnung nicht zu überfrachten, wurden Glycolyse, Citratzyklus und Atmungskette nur in der Muskulatur und Leber dargestellt. Sie findet aber grundsätzlich in allen Zellen statt. Ebenfalls wurde auf die Darstellung der Gluconeogenese in den Nieren verzichtet.
(2) Blutzuckerregulation durch Hypothalamus-Rückkopplung
Neben der Verstoffwechselung der Nahrungsglukose besteht Regelbedarf bei erhöhten Energiebedarfen im Falle gesteigerter Aktivitäten und Stress, bei denen vor allem Nerven- und Muskelzellen unabhängig von der Nahrungsaufnahme besonders schnell und besonders viel Glukose benötigen.
Die dazu nötigen Steuerungsmechanismen unterscheiden sich erheblich von denen der Pankreas-Rückkopplung. Im Zentrum steht der Hypothalamus, der im Pankreas-Regelkreis ausschließlich eine passive Rolle als Vorgabeinstanz für den Glukose-Sollwert spielt. Für den Glukosebedarf bei vermehrter Aktivität und hohem Stress ist der Hypothalamus als oberste Steuerungsinstanz auch aktiv für Messung und Regelung des Glukoseangebots zuständig.
Dass gerade der Hypothalamus diese wichtige Rolle übernimmt ist naheliegend, denn durch ihn wird die Hormonsynthese bei hohem Aktivitäts- und Stresslevel insgesamt gesteuert, so dass die Blutglukosewertregulierung gleich miterledigt werden kann.
Die Hypothalamus-Steuerung spielt auch im Falle drohender Glukosemangelversorgung eine Rolle, beispielsweise nach längerfristigem Nahrungsstopp.
Es werden drei Subregelkreise unterschieden:
- Thyreotroper Regelkreis der Hypothalamus-Hypophysen-Schilddrüsen-Achse
Die Schilddrüsenhormone T3 und T4 steuern wesentlich den Stoffwechsel des Körpers, indem sie den Grundumsatz halten und bei vermehrten Aktivitäten auf Leistungsumsatz anpassen. Beide Substanzen regen direkt die Glucogenese in Leber- und Muskelzellen und die Gluconeogenese in Leber und Nieren an.
Der Hypothalamus misst ständig die T3- und T4-Konzentrationen im Blut und sezerniert das Thyreotropin-Releasing-Hormon TRH, falls sie nicht mit den aktuellen Anforderungen übereinstimmen. Daraufhin schüttet die Hypophyse das thyroidstimulierende Hormon TSH aus und kurbelt damit die Produktion von T3 und T4 in der Schilddrüse an. T3 und T4 stimulieren Glucogenese und Gluconeogenese und führen zu einem Blutzuckeranstieg.
- Corticotroper Regelkreis der Hypothalamus-Hypophysen-Nebennierenrinde-Achse
Der Regelkreis zur Nebennierenrinde gilt als der Wichtigste für die Stressbewältigung. Hier steht das Nebennierenrindenhormon Cortisol im Mittelpunkt, das unter anderem Glukosepotentiale mobilisiert. Cortisol gehört zur Hormongruppe der Glukokortikoide, deren Gruppenname schon auf ihre Bedeutung im Zusammenhang mit der Blutzuckerregulation hinweist.
Der Hypothalamus prüft als oberste Steuerinstanz die Blutcortisolwerte und schüttet im Bedarfsfall das Releasing-Hormon CRH aus. CRH pariert mittels verschiedener Körperreaktionen Stress, wirkt jedoch vor allem auf die Hypophyse, die daraufhin ACTH sezerniert und die Nebennierenrinde direkt zur Cortisolausschüttung antreibt. Eine forcierte Glucogenese bzw. Gluconeogenese sorgt dann für die dringend benötigte zusätzliche Glukose.
Cortisol behindert auch die Glukoseaufnahme der Fettzellen, was einen weiteren Blutzuckeranstieg zur Folge hat.
Darüber hinaus verstärkt Cortisol sowohl die Wirkung des blutzuckersteigernden Glukagons als auch die Wirkung von Adrenalin. Adrenalin erhöht ebenfalls den Blutzuckerspiegel, was zur dritten und letzten Hypothalamus-Regelachse überleitet.
- Neuronaler Regelkreis der Hypothalamus-Sympathikus-Nebennierenmark-Achse
Die Stresshormone Adrenalin und Noradrenalin des Nebennierenmarks erhöhen ebenfalls den Blutzuckerspiegel.
Die Regelung erfolgt dabei nicht über die Ausschüttung von Releasing-Hormonen in den Blutkreislauf. Der Hypothalamus regt bei Stress die Adrenalin- und Noradrenalinproduktion über das Rückenmark und das periphere sympathische Nervensystem direkt und sehr schnell an. Die Nervenreize bewirken im Nebennierenmark eine Ausschüttung von Acetylcholin, woraufhin Adrenalin und Noradrenalin in die Blutbahn abgegeben werden und eine rasche Mobilisierung von Glucogenese und Gluconeogenese erfolgt.
Ein Grund für die neuronale Aktivierung könnte die Blut-Hirn-Schranke sein, welche Adrenalin und Noradrenalin nicht passieren lässt, so dass eine Rückkoppelung im Hypothalamus nicht direkt möglich ist.
4.8.6 Ursachen hypoglykämischer Fehlregulationen
Hypoglykämie kann viele verschiedene Gründe haben. Prinzipiell gibt es drei Ursachenkomplexe:
- Hypoglykämie als Folge von Erkrankungen der Organe bzw. Organsysteme, die an der Blutzuckerregelung beteiligt sind.
- Hypoglykämie als Folge der Ernährungsweise.
- Hypoglykämie aus sonstigen Gründen.
(1) Hypoglykämische Blutzuckerkurvenverläufe als Folge dysfunktionaler Regelkreisorgane
Alle Organe, die an der Blutzuckerregelung unmittelbar oder mittelbar beteiligt sind, können potentiell hypoglykämische Zustände verantworten. Aufgrund ihrer Funktionen in den Regelkreisen sind Störungsprognosen möglich, ebenfalls kann man den daraus resultierenden Blutzuckerkurvenverlauf abschätzen.
TABELLE 16: ORGANFEHLFUNKTIONEN UND GLUKOSEFEHLREGULIERUNG
Organ(-system) |
Funktionen in den Regelkreisen |
Blutzuckerrelevante Folgen bei Dysfunktionalität |
Potentielle Auswirkungen auf den Blutzuckerkurvenverlauf |
|---|---|---|---|
| Hypothalamus | - Messung Blutzucker - Vorgabe Glukose-Sollwert an Langerhanszellen B - Sättigungszentrum - Messung T3/T4-Werte - Sollwertbestimmung T3/T4 - Ausschüttung TRH an Hypophyse (-> S.drüse) - Messung Cortisolwert - Sollwertbestimmung Cortisol - Ausschüttung CRH an Hypophyse (-> Nn.rinde) - Steuerung Nn.mark über peripheres Nervensystem |
- Generell zu geringe Glukose- Sollwertvorgaben oder bedingt durch Messfehler - Fehlerhafte Sättigungssignale führen zu unzureichender Kohlenhydrataufnahme - Fehlmessungen bei T3/T4 oder zu wenig TRH führen zu einer unzureichenden Mobilisierung der Schilddrüse - Cortisol-Fehlmessungen oder zu wenig CRH führen zu einer unzureichenden Mobilisierung der Nebennierenrinde - Unstetige Steuerung von Glucogenese und Gluconeogenese - Zu wenig Nervenreize führen zu einer unzureichenden Mobilisierung des Nn.marks |
- Blutglukose zu niedrig, z. B. unter 75 mg/dl*, oft dauerhaft - Blutzuckerkurve generell zu flach bei geringem Spitzenwert - Blutzuckerkurve fällt generell zu schnell - Schwankungen im Blutzuckerverlauf |
| Hypophyse | - Ausschüttung TSH an Schilddrüse - Ausschüttung ACTH an Nebennierenrinde |
- Unzureichende Mobilisierung der Schilddrüse durch zu wenig TSH - Unzureichende Mobilisierung der Nebennierenrinde durch zu wenig ACTH |
- Blutglukose zu niedrig, z. B. unter 75 mg/dl*, oft Dauer- zustand - Blutzuckerkurve generell zu flach bei geringem Spitzenwert - Blutzuckerkurve fällt bei Tägtigkeit bzw. Anstrengung oder Stress zu schnell |
| Peripheres Nervensystem und Rückenmark |
- Nervenreize des Hypothalamus an Nn.mark weiterleiten, wobei die Reizumschaltung über das Rückenmark erfolgt | - Gestörte Reizübertragung durch das Rückenmark | - Blutzuckerkurve bei Stress zu flach bei geringem Spitzenwert - Blutzuckerkurve fällt bei Stress zu schnell |
| Schilddrüse | - Ausschüttung T3, T4 | - Zu geringer Stoffwechsel- grundumsatz durch zu geringe T3-T4-Werte (Unterfunktion) - Zu geringer Leistungsumsatz durch zu geringe T3-T4-Werte (Unterfunktion) |
- Blutglukose ständig zu niedrig, z. B. unter 75 mg/dl* - Blutzuckerkurve generell zu flach bei geringem Spitzenwert - Blutglukose bei Leistung und Stress zu niedrig |
| Leber | - Glycogenese - Glucogenese - Gluconeogenese |
- Zu geringe Glukosebildung aus Speicherzucker - Zu geringe Glukoseneubildung aus Aminosäuren - Durch eingeschränkte Leberfunktion wird weniger Insulin benötigt, was vom Pankreas nicht adaptiert wird |
- Nüchternglukose zu niedrig - Blutzuckerkurve fällt generell zu schnell - Wechsel zwischen hyperglykämischen und hypoglykämischen Zuständen |
| Langerhanszellen des Pankreas | - Messung Glukose-Istwert durch B-Zellen - Ausschüttung Insulin - Ausschüttung Glukagon |
- Messungen der Blutzucker- konzentration oder Soll-Ist- Abgleich fehlerhaft - Übermäßige/schwankende Insulinproduktion - Unzureichende/schwankende Glukagonproduktion |
- Blutzucker generell zu niedrig - Blutzucker sinkt kurz nach Beginn der Nahrungsaufnahme unter den Nüchternwert - Blutzuckerkurve generell zu flach bei geringem Spitzenwert - Blutzuckerkurve fällt generell zu schnell - Schwankungen im Blutzuckerverlauf |
| Nierenrinde | - Gluconeogenese | - Zu geringe Glukoseneubildung aus Aminosäuren | - Nüchternglukose zu niedrig - Blutzuckerkurve fällt generell zu schnell |
| Nebennierenrinde | - Ausschüttung Cortisol | - Unzureichende Stressreaktion durch unzureichende Synthese von Cortisol bei zu geringer Gluconeogenese und zu geringer Glucogenese | - Blutzuckerkurve bei Stress zu flach bei geringem Spitzenwert - Blutzuckerkurve fällt bei Stress zu schnell |
| Nebennierenmark | - Ausschüttung Adrenalin - Ausschüttung Noradrenalin |
- Unzureichende Stressreaktion durch unzureichende Adrenalin- Noradrenalin-Synthese bei zu geringer Gluconeogenese und zu geringer Glucogenese |
- Blutzuckerkurve bei Stress zu flach bei geringem Spitzenwert - Blutzuckerkurve fällt bei Sress zu schnell |
| Dünndarm | - Glukoseaufnahme aus Nahrung - Ausschüttung GLP-1 an Langerhanszellen und Hypothalamus |
- Verlust von Glukose - Fehlsignale an Hypothalamus und Langerhanszellen durch zu hohe GLP-1-Ausschüttung |
- Geringer Spitzenwert - Gefahr eines generell zu niedrigen Blutglukosewertes |
Tabelle 16: Bei den Auswirkungen auf den Blutzuckerkurvenverlauf in der Spalte rechts sind die Wahrscheinlichsten genannt. Weitere Auswirkungen sind nicht ausgeschlossen. Es ist zu berücksichtigen, dass die Entwicklung der Blutzuckerwerte auch davon abhängt, wie sich einzelne Regelmechanismen gegenseitig ausgleichen oder auch in ihrer negativen Wirkung verstärken. Fehlfunktionen mehrerer beteiligter Organe sind wahrscheinlich und eine 100%ig zutreffende Prognose ist nicht immer möglich. Auch der Umstand, dass unterschiedliche Organfehlfunktionen gleiche Fehlregulierungen als Folgen haben können, erschwert eine Prognose erheblich.
*) 75 mg/dl entsprechen 4,2mmol/l
Auch die Gründe für Organfehlfunktionen sind vielfältig, in Tabelle 17 sind die wichtigsten Ursachen aufgelistet. Auswirkungen des Koffein- und Alkoholkonsums werden unter (3) diskutiert.
TABELLE 17: URSACHEN FÜR STÖRUNGEN GLUKOSEREGULIERENDER ORGANE
Organ(-system) |
Wichtige Ursachen von Dysfunktionalität |
|---|---|
| Hypothalamus | - Gut- oder bösartige Hypothalamustumore - Verletzungen des Hypothalamus, Schädel-Hirn-Trauma - Eingeschränkte Organtätigkeit aus sonstigen Gründen (Allgemeine Organinsuffizienz) |
| Hypophyse | - Gut- oder bösartige Hypophysentumore - Verletzungen der Hypophyse, Schädel-Hirn-Trauma - Eingeschränkte Organtätigkteit aus sonstigen Gründen |
| Peripheres Nervensystem und Rückenmark |
- Unterbrechung der Reizleitung, z. B. durch Bandscheibenvorfall, Durchtrennung des Nervs oder Rückenmarktumor - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
| Schilddrüse | - Gut- oder bösartige Schilddrüsentumore - Entzündung, z. B. Hashimoto-Thyreoiditis - Angeborene Schilddrüsenunterfunktion - Fehlende Schilddrüse, z. B. nach OP oder erblich bedingt - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
| Leber | - Leberkarzinom - Leberentzündung (insbesondere chronische Hepatitis) - Leberzirrhose - Alkoholabusus (→ Abschnitt 4.8.4) - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
| Pankreas und Langerhanszellen | - Insulinom (meist gutartiger Tumor der Inselzellen) - Pankreatitis - Pankreastumor - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
| Nierenrinde | - Nierenerkrankungen mit Auswirkungen auf die Nierenrinde - Eingeschränkte Nierenrindentätigkeit aus sonstigen Gründen |
| Nebennierenrinde | - Primäre Nebennierenrindeninsuffizienz (Morbus Addison) - Erschöpfung der Nebennierenrinde bei Dauerstress - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
| Nebennierenmark | - Insuffizienz des Nebennierenmarks, z. B. durch Tumore, nach OP - Erschöpfung des Nebenierenmarks bei Dauerstress - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
| Dünndarm | - Sämtliche Dünndarmerkrankungen, z. B. Morbus Crohn, Reizdarm - Nach Dünndarmoperationen - Eingeschränkte Organtätigkeit aus sonstigen Gründen |
Tabelle 17: Allen Organenfehlfunktionen ist gemein, dass sie auch auf degenerativen Vorgängen beruhen können, beispielsweise altersbedingt, aufgrund chronischer Überforderung oder aus anderen Gründen. Bei den hormonsezernierenden Organen ist die korrekte Bezeichnung dafür „Hormonelle Insuffizienz“.
(2) Hypoglykämische Blutzuckerkurvenverläufe aufgrund von Einflüssen des Ernährungsverhaltens
Blutzuckerwerte werden vom Ernährungsverhalten mitbestimmt, denn die Aufnahme von Kohlenhydraten, Proteinen und Mikronährstoffen hat unmittelbare Auswirkungen auf Blutzuckerwerte und Regelsysteme.
Die Auswirkungen unterschiedlicher Kohlenhydratestrukturen sind leicht nachvollziehbar: Je kurzkettiger Kohlenhydrate sind, desto schneller werden sie vom Körper aufgenommen und desto schneller steigt der Blutzuckerwert. Ein‑ und Zweifachzucker, beispielsweise Traubenzucker (Glukose) oder Haushaltszucker, werden vom Dünndarm daher schnell ins Blut geschleust. Langkettige Mehrfachzucker in der Form von Stärke ‑ auch als „komplexe Kohlenhydrate“ bezeichnet ‑ gelangen nur langsam ins Blut, denn das Verdauungssystem muss sie vorher in einem zeitintensiven Prozess in Einfachzucker zerlegen.
Was bedeutet nun eine durchschnittlich große Mahlzeit einschließlich Getränk, die fast ausschließlich aus kurzkettigen Kohlenhydraten in Form von Zweifachzuckern besteht, beispielsweise Kuchen und einem halben Liter gezuckerter Limonade, für Blutzuckerregelungssysteme und Blutzuckerkurvenverlauf?
Bei einem funktionierenden Regelsystem verläuft der Anstieg der Kurve steiler als üblich, da die Zuckermoleküle rasch ins Blut übergehen. Die Langerhanszellen produzieren daraufhin eine angemessen große Menge Insulins zwecks Verwertung des plötzlich großen Glukoseangebots, so dass der Blutzuckerwert entsprechend schnell wieder sinkt, wenn aus dem Verdauungssystem keine Glukose nachgeliefert wird. Ein zu rascher Glukoseabsturz nach Erreichen des Spitzenwertes löst bei funktionierenden Regelkreisen die Glucogenese aus, so dass sich der Blutzuckerabfall verlangsamt.
Durch den schnellen Blutzuckerabfall könnte rasch wieder Hunger verspürt werden. Werden dann wieder schnell verwertbare Zuckerprodukte konsumiert, wiederholt sich das Ganze. Der Konsum von Ein- und Zweifachzuckern ist daher auch bei funktionierenden Regelsystemen nicht besonders nachhaltig und bedeutet für diese darüber hinaus erheblichen Stress. Ein gesundes Blutzuckerregelsystem wird dennoch mit einer zuckerreichen Ernährung fertig.
Bei einem gestörten Regelsystem mit Neigung zu hypoglykämischen Reaktionen überfordert die große Menge an schnell verwertbarem Zucker Regelorgane bzw. Regelkreise. Es kann zu folgenden anormalen Reaktionen kommen:
- Die Langerhanszellen schütten sofort eine übermäßig hohe Menge Insulins aus, die den Bedarf bei weitem übersteigt. Es kommt schon kurz nach der Nahrungsaufnahme zur Nüchternwertunterschreitung des Blutzuckers, die in der Folge zu einer Notreaktion von Hypothalamus und Nebennieren führt. Jetzt werden Adrenalin, Noradrenalin und/oder Cortisol ausgeschüttet und die Glucogenese ausgelöst. Dadurch gelangt zu Glukose umgewandelter Speicherzucker in den Blutkreislauf, so dass der Blutzuckerwert schnell wieder steigt. Die Bedingung für die Glucogenese ist jedoch, dass beide Teilregelkreise via Hypothalamus und Nebennieren ausreichend funktionieren. Tun sie das nicht, kann die Nüchternwertunterschreitung extremer ausfallen oder auch langfristiger anhalten.
- Eine zu hohe Insulinmenge kann auch zum schnellen Absturz des Blutzuckers nach Erreichen des Spitzenwertes führen ‑ ganz unabhängig davon, ob es am Beginn zu einer Nüchternwertunterschreitung gekommen ist oder nicht. Ein funktonierendes System wirkt dem mit der Glucogenese entgegen und fängt diesen Absturz locker auf, bei einem gestörten System unterbleibt dieser Schutzmechanismus.
- Ebenfalls besteht die Möglichkeit, dass eine plötzliche Steigerung des Blutzuckerwerts durch die Glukogenese wiederum Gegenreaktionen des Pankreas-Regelkreises provozieren und es zu einer erneuten Nüchternwertunterschreitung kommt.
- Bei einem stark geschädigten Regelsystem führt die Überforderung möglicherweise auch zu massiveren Auffälligkeiten im Kurvenverlauf, beispielsweise häufigeren Glukosewertschwankungen, einschließlich mehrfachen Nüchternwertunterschreitungen.
- Ein stark gestörtes Regelsystem neigt auch bei der Aufnahme langkettiger Kohlenhydrate zu vergleichbaren Überreaktionen, eventuell mit einer etwas verminderten Intensität als bei Ein- oder Zweifachzuckern.
Es gibt viele Ursachen für Regelkreisorganerkrankungen (→ Tabelle 17), sie können auch durch langfristiges Ernährungsfehlverhalten negativ beeinflusst werden. So begünstigt ständiger Konsum überwiegend kurzkettiger Kohlenhydrate aufgrund der permanenten Überlastung potentiell Erkrankungen der Regelorgane.
Eine weitere Konsequenz des ständigen Konsums von Lebensmiitteln mit hohem Zuckeranteil sind erschöpfte Langerhanszellen, einhergehend mit einer eventuell entstehenden Insulinresistenz der Zellen, was dann auf lange Sicht zu einem völlig anderen Problem führen kann, nämlich der Gefahr eines Diabetes mellitus Typ 2.
Die Folgen des Verzehrs von Auszugs- oder Weißmehl ähneln denen kurzkettiger Kohlenhydrate. Zwar besteht Weißmehl hauptsächlich aus Stärke und nicht aus Ein- oder Zweifachzuckern, jedoch fehlen ihm - im Gegensatz zum Vollkornmehl - die natürlichen Balaststoffe und ein Großteil der Vitamine, Mineralstoffe und Spurenelemente. Weißmehlstärke wird aus diesen Gründen schneller als die Stärke aus vollem Korn in Glukose zerlegt, so dass auch hier die Gefahr einer vergleichbaren hypoglykämischen Reaktion besteht.
Die Problematik für die Regelsysteme bei Aufnahme einer großen Kohlenhydratemenge in sehr kurzer Zeit ‑ unabhänbgig von dessen molekularer Struktur ‑ ist vergleichbar mit der Problematik des Ein‑ oder Zweifachzuckerkonsums. Hier gilt ebenfalls: Korrekt arbeitende Regelysteme werden keine Schwierigkeiten haben, auch große Glukosemengen auf einmal zu bewältigen und den Blutzuckerverlauf optimal zu gestalten, während dysfunktionale Systeme hier in der Regel überfordert sind.
Auch eine mittel- bis langfristige Kohlenhydratereduktion hat Auswirkungen auf Regulationssysteme und Blutzuckerkurve. Eine bewusster Verzicht auf Kohlenhydrate wird aus Gründen des Übergewichtsabbaus oder einer generell als gesünder angesehenen Ernährungsweise propagiert und täglich millionenfach durchgeführt. Auf den ersten Blick ist die Befürchtung plausibel, mit einer glukosearmen Ernährungweise könne die Gefahr einer Hypoglykämie einhergehen.
Beispielsweise basieren mehrere „Ernährungsphilosophien“ zur Gewichtsreduktion auf der Idee, dies durch eine Verminderung des Kohlenhydratekonsums zugunsten von Proteinen und Fetten zu erreichen. Schon seit dem 19. Jahrhundert gibt es in der Ernährungslehre Überlegungen über Vor- und Nachteile der Senkung des Kohlenhydrateanteils in der Nahrung. Sie werden heutzutage unter verschiedenen Namen propagiert, zu nennen sind Low-Carb-Methode, Atkins-Diät oder die „Steinzeit-Diät“.
Die Kohlenhydratereduktion soll zum langfristigen Fettabbau und einer dauernden Gewichtsabnahme führen. Ein Teil der Anhänger kohlenhydratereduzierter Kost vermutet, dass die Verdauungs- und Regulationssysteme des Menschen nicht mit der heutigen Ernährungsweise harmonieren, bei der Kohlenhydrate in der Regel im Mittelpunkt stehen. Somit wären die Blutzuckerregulationssysteme der Menschen heutzutage generell überfordert. Es wird behauptet, die Menschen in ferner Vergangenheit ernährten sich fast ausschließlich von Fleisch, Nüssen und Früchten, da mit dem Getreideanbau in Europa erst in der Jungsteinzeit ‑ also frühestens vor ca. 11.000 Jahren ‑ begonnen wurde und sich das menschliche Verdauungssystem noch nicht auf diese Situation umgestellt hätte. Einen wissenschaftlichen Nachweis dieser These gibt es nicht.
Für eine Ernährung mit wenig Kohlenhydraten sind hinsichtlich der Kohlenhydratmenge keine allgemeinen Richtlinien bekannt, die Methoden weichen voneinander ab. Der Einfachheit halber werden zwei Grenzwerte diskutiert:
- Begrenzung der Zufuhr auf etwa 70 bis 110 gr Kohlenhydrate pro Tag. Hier wird die geringe Kohlenhydratmenge bei funktionierenden Regelkreisen durch verstärkte Glucogenese und mittel- bis langfristig durch die Gluconeogenese ausgeglichen; für Letztere muss die Nahrung allerdings genügend Proteine enthalten. Speicherzuckervorräte können bei dieser Kohlenhydratezufuhr mittels Glykogenese ausreichend gebildet werden.
- Begrenzung der Zufuhr auf etwa 30 bis 50 gr Kohlenhydrate oder weniger pro Tag. Bei dieser Ernährung kommt es zu einer massiven Umstellung des Glukosestoffwechsels, denn Leber und Nieren sind auch mit der Gluconeogenese nicht mehr in der Lage, den Glukoseengpass auszugleichen.
Zum Vergleich: Im Durchschnitt nimmt ein Mensch mit konventioneller Mischkost ca. 200 bis 250 gr Kohlenhydrate pro Tag auf, wobei ein nicht unbeträchtlicher Teil der Bevölkerung sogar wesentlich höhere Mengen konsumiert.
Die kurz- bis mittelfristigen Auswirkungen auf die Glukoseversorgung sind bei einer kohlenhydratebegrenzten Kost mit ca. 70 bis 110 mg Kohlenhydraten pro Tag und einem funktionierenden Regelsystem:
- Flacher und langsamer Anstieg der Blutzuckerkurve, so dass es auch zu einer geringeren Steigerung der Insulinproduktion kommt.
- Ein Abfall unter den Nüchternwert ist unter diesen Bedingungen ausgeschlossen.
- Ggf. ein mäßig reduzierter Blutzuckerspitzenwert.
- Optimaler, eher langsamer Abfall der Kurve nach dem Spitzenwert, bedingt durch die Fähigkeit des Körpers, neben der Glucogenese auch die Gluconeogenese ‑ also die Glukosesynthese aus Aminosäuren ‑ verstärkt für die Energieversorgung zu nutzen.
- Keine Schwankungen des Blutzuckerkurvenverlaufs.
- Keine Nüchternwertunterschreitung.
Bei dysfunktionalem Regelsystem sind optimale Blutzuckerkurvenverläufe bei dieser Ernährungsweise nicht garantiert. Es kann zu folgenden Problemen kommen:
- Sowohl Nüchtern- als auch Spitzenwert werden vom System generell zu niedrig eingestellt.
- Die Mobilisierung von Glucogenese und/oder Gluconeogenese funktioniert nicht optimal.
- In der Folge sind Schwankungen des Blutzuckerkurvenverlaufs möglich.
- Es kann zu einem Abfall des Blutzuckerwertes unter den Nüchternwert kommen.
- Ggf. sinkt die Blutzuckerkurve nach Erreichen des Spitzenwertes zu schnell.
Wenn die Aufnahme von Kohlenhydraten unter 50 gr pro Tag fällt, reichen sämtliche Glukosemengen, die der Körper mobilisieren kann, nicht mehr aus. Damit das wichtigste glukoseabhängige Organ, das Zentralnervensystem, dennoch genügend Energie erhält, reagiert der Stoffwechsel mit der Ketose. Es werden nun durch Verbrennung von Fett in der Leber Ketone gebildet, die das Gehirn als Energieträger akzeptiert.
Ergebnis: Es ist nicht ausgeschlossen, dass es aufgund der besonderen Situation einer massiv kohlenhydratereduzierten Ernährung mit weniger als 50 gr pro Tag auch bei einem ansonsten funktionierenden Regelsystem zur Hypoglykämie kommt.
Auf die Problematik des Auszugs- bzw. Weißmehlkonsums mit Mikronährstoffdefiziten wurde oben schon hingewiesen. Der Verzehr von Weißmehlprodukten, denen Ballast‑ und Mikronährstoffe durch industrielle Verarbeitung entzogen wurden, kann zu Glukoseverwertungsstörungen und in der Folge zur Hypoglykämie führen, denn der Glukosestoffwechsel ist ‑ wie alle Prozesse im Körper ‑ von der Anwesenheit bestimmter Mikronährstoffe abhängig. Auch Süssigkeiten enthalten außer Zucker und Weißmehl nur winzige Mengen dieser wichtigen Vitalstoffe und darüber hinaus ebenfalls keine Ballaststoffe.
Wichtige Fragen sind nun, welche Mikronährstoffe eine Rolle bei der Glukoseaufnahme und ‑verwertung spielen, welche Aufgaben sie dabei übernehmen und welchen Unregelmäßigkeiten Substanzdefizite zur Folge haben können.
Die wichtigsten kohlendydraterelevanten Mikronährstoffe sind Magnesium, Vitamin B3 (Niacin), Chrom und Zink.
Magnesiummangel hat im Kohlenhydratestoffwechsel drei Aspekte:
- Gemeinsam mit Insulin ist Magnesium für den Glukosetransport in die Zellen unverzichtbar. Bei Magnesiummangel besteht daher die Gefahr eines Energiemangels aufgrund der Minderversorgung der Zellen mit Glukose.
- Ein Magnesiummangel kann sich durch eine Insulinüberproduktion bemerkbar machen. Dies könnte eine Folge des mangelhaften Glukosetransports sein (→ Nr. 1), denn der Körper versucht jetzt, mit einer massiv gesteigerten Insulinproduktion entgegenzusteuern. Dadurch besteht die Gefahr, dass die Blutzuckerkonzentration zu schnell absinkt oder sogar unter den Nüchternwert fällt.
- Parallel werden die blutzuckersteigernden Prozesse Glucogenese und Gluconeogenese massiv unterdrückt.
Nervenzellen bedienen sich zur Glukoseaufnahme des insulinunabhängigen Glukosetranporters Typ 3 und benötigen deshalb kein Insulin, im Gegensatz zu allen anderen Zellen. Die erstgenannte Funktion des Magnesiums spielt daher im Gehirn keine Rolle. Es ist somit plausibel, dass sich im Nervensystem nur Effekte des zu schnellen Absinkens des Blutzuckerspiegels und/oder das Absinken unter den Nüchternwert bei Magnesiummangel direkt negativ bemerkbar machen.
Vitamin B3 bzw. Niacin und das Spurenelement Chrom haben als Bestandteile des Glukosetoleranzfaktors GTF eine hohe Bedeutung für den Kohlenhydratstoffwechsel.
Der Glukosetoleranzfaktor ist für das Andocken des Insulins an die Insulinrezeptoren mitverantwortlich und erhöht die Insulinsensibilität der Körperzellen. Dieser Vorgang ist eine Grundvoraussetzung für das Einschleusen der Glukose ins Zellinnere. Darüber hinaus ist der GTF auch am umgekehrten Prozess beteiligt, also dem Transport des durch Glucogenese zu Glukose umgewandelten Speicherzuckers aus den Leberzellen in den Blutkreislauf.
Ein Niacin- oder Chrommangel kann daher ggf. ähnliche Konsequenzen haben wie ein Magnesiummangel:
- Der GTF ist für den Glukosetransport in die Zellen unverzichtbar. Bei Niacin- oder Chromangel besteht daher die Gefahr eines Energiemangels aufgrund der Minderversorgung der Zellen mit Glukose.
- Da der Körper aufgrund der GTF-Dysfunktionalität durch Niacin- und/oder Chrommangel Schwierigkeiten hat, die Glukose in die Zellen zu bekommen, kommt es zu einer Insulinüberproduktion. Die überproportionale Insulinsteigerung gleicht die GTF-Mängel nicht nur aus, es kommt potentiell auch zum hypoglykämischen Nebeneffekt mit schnellem Absinken der Blutzuckerkurve und/oder einer Nüchternwertunterschreitung.
- Bei GTF-Dysfunktionalität werden blutzuckersteigernde Aktivitäten, wie Glucogenese und Gluconeogenese, unterdrückt, so dass eine Gegensteuerung erst mit einer Verzögerung beginnen kann oder sogar völlig ausbleibt.
Zink ist sowohl ein Bestandteil von Insulin als auch an seiner Synthese beteiligt. Dennoch ist wenig über die Rolle von Zink bei Hypoglykämie bekannt. Dazu führt Michael Martin in seinem Buch aus: „(...) Allerdings findet sich auch bei Patienten mit Hypoglykämie-Syndrom immer wieder ein intrazelluläres Zinkdefizit. Vermutlich bedingt Zinkmangel allgemein hormonelle Regulationsschwächen. (...) Eine Beeinträchtigung der Funktion der Hypothalamus-Hypophysen-Nebennierenrindenachse wird seit kurzer Zeit aufgrund zahlreicher Befunde vermutet. Die Folge: Eine Abnahme der Stresstoleranz sowie eine Beeinträchtigung weiterer, von der Hormonachse abhängiger Regulationsvorgänge.“ (Quelle: Michael Martin, Das Hypoglykämie-Syndrom, Ralf Reglin Verlag, 1. Auflage, Köln 1996).
(3) Sonstige Ursachen einer Hypoglykämie
Weitere Erkrankungen oder bestimmte Substanzen bzw. negative Umweltbedingungen, denen man sich aktiv oder passiv aussetzt, können als interne oder externe Auslöser bzw. Noxen zu Störungen regelkreisrelevanter Organe und damit zur Hypoglykämie führen.
Da Teile des Zentralnervensystems bei allen Regelkreisen eine wichtige Steuerungs- und Regelungsinstanz sind, gelten prinzipiell sämtliche Neurotoxine als potentiell gefährlich. Die relativ kleinen Hirnareale von Hypothalamus und Hypophyse können durch körperfremde giftige Substanzen derart geschädigt werden, dass sie ihre Funktionen dauerhaft nicht mehr erfüllen. Dann wird unter anderem auch die Blutzuckerkonzentration nicht mehr situationsgerecht angepasst. Da im Gehirn zahlreiche Substanzen bei der Reizübertragung beteiligt sind, ist auch die Anzahl neurotoxisch wirkender Stoffe entsprechend hoch (→ Abschnitt über Gift- und Gefahrenstoffe im Kapitel 4 B).
Zu den in Lebensmitteln vorkommenden Neurotoxinen zählt beispielsweise auch Alkohol, der aufgrund seiner hohen Lebertoxizität schon thematisiert wurde. Die Lebertoxizität ist im Zusammenhang mit Hypoglykämie der Hauptgesichtspunkt, da Glycogenese, Glucogenese und Gluconeogenese von einer funktionsfähigen Leber abhängen. Dass Alkohol langfristig auch geeignet ist, die zentralen Steuerungsorgane Hypothalamus und Hypophyse zu schädigen, steht außer Frage. Da Alkoholiker häufig zu wenig Nahrung ‑ und damit zu wenig Kohlenhydrate ‑ aufnehmen, besteht aus einem weiteren Grund Hypoglykämiegefahr.
Im Alltag sind vor allem chemische Stoffe bedenklich, die auf Chlorbasis industriell produziert werden und heute in vielen Produkten enthalten sind, zum Beispiel in Holzschutzmitteln, Möbeln und Kunststoffen. Bis zu ihrem Verbot waren viele chlorbasierte Insektizide auf dem Markt. Heutzutage enthalten viele Pestizide neurotoxische Phosphorsäureester oder E 605.
Auch andere regelkreisbeteiligten Organe werden durch Toxine negativ beeinflusst. Pentachlorphenol (PCP) schädigt beispielsweise neben der Leber auch die Schilddrüse, Tetrachlorkohlenstoffe sind lebertoxisch.
Koffein gilt zwar in höheren Dosen auch als neurotoxisch, aber im Zusammenhang mit Hypoglykämie ist dessen stimulierende Wirkung auf die Insulinproduktion von Bedeutung. Koffein kurbelt nämlich auch in kleineren Mengen zunächst über eine Erhöhung des Adrenalinausstoßes die Glucogenese an, was blutzuckersteigernd wirkt und damit auch die Insulinproduktion erhöht. Parallel senkt Koffein aber auch die Sensibilität der Zellen für Insulin mit der Folge einer noch stärken Insulinsekretion, so dass sich beide Wirkungen summieren.
Koffein lässt daher zunächst den Blutzucker ansteigen, jedoch sinkt er danach durch den provozierten Insulinüberschuss schnell. Es kommt zu starken Schwankungen oder sogar einem Abfall unter den Nüchternzucker, zum Beispiel bei Kaffeegenuss auf nüchternen Magen, dem auch keine anschließende Aufnahme komplexer Kohlenhydrate folgt. Wird der Kaffee dann auch noch mit Zucker gesüßt und folgt darauf vielleicht sogar noch Kuchen oder eine andere gezuckerte Süßspeise, kann sich der Insulinausstoß nochmals drastisch erhöhen ‑ mit weiteren negativen Folgen auf den Blutzuckerverlauf.
Auch Körperbereiche, die in keinem direkten Zusammenhang mit der Glukosemessung und ‑regelung stehen, können Einflüsse auf die Blutzuckerentwicklung nehmen.
Unter dem Spät-Dumping-Syndrom versteht man eine Form der schnellen bzw. sturzartigen Magenentleerung in den Zwölffingerdarm nach der operativen Entfernung des als Pylorus bezeichneten Magenpförtners. Der Pylorus ist für die portionsweise Abgabe des vorverdauten Nahrungsbreis in den Zwölffinderdarm zuständig und diese Funktion fällt nach Anwendung bestimmter Magenoperationstechniken komplett aus. Auch bei anderen Störungen bzw. Erkrankungen des Magenpförtners kann es zu diesem Phänomen kommen.
Die beschleunigte Magenpassage führt vor allem bei zucker- bzw. kohlenhydratreicher Kost zu einer übermäßig hohen Insulinausschüttung durch das kurzfristig hohe Glukoseangebot und ist mit einer Unterzuckerungsgefahr verbunden.
Die Nieren sind nicht nur durch die Gluconeogenese der Nierenrinden für den Kohlenhydratestoffwechsel von Bedeutung. Ihre Hauptfunktion ist die Ausscheidung schädlicher („harnpflichtiger“) Stoffe über den Urin. Dabei sind jedoch wertvolle Stoffe zu resorbieren und an den Blutkreislauf zurückführen, unter anderem auch Glukose.
Liegt keine Diabetes mellitus mit einem abnorm hohen Blutzuckerspiegel vor, sollte der Glukoseverlust, auch renale Glukose-Exkretionsrate genannt, bei Erwachsenen unter ca. 65 mg Glukose pro Tag liegen. Verliert man aufgrund eingeschränkter Nierenfunktionen oder schon fortgeschrittener Niereninsuffizienz im Nüchternzustand mehr als 15 mg/dl Glukose über den Urin, liegt eine Renale Glucosurie mit der Gefahr hypoglykämischer Zustände vor (→ Tabelle 16).
Bestimmte Tumorarten, nicht ganz korrekt als extrapankreatische Tumore bezeichnet, können überall im Körper entstehen und hypoglykämische Störungen zur Folge haben, denn sie produzieren unkontrollierbar Substanzen, die den Kohlenhydratstoffwechsel beeinträchtigen:
- Produktion von Insulin oder insulinähnlichen Substanzen.
- Produktion von Substanzen, die Langerhanszellen zur Insulinsekretion provozieren.
- Produktion von Substanzen, welche die Glucogenese oder Gluconeogenese behindern.
Dazu gesellt sich die Problematik des hohen Zuckerbedarfs von Tumoren, vor allem bei schneller Zellteilung, was bei malignen Tumoren (Karzinomen) fast immer der Fall ist und eine Hypoglykämie (mit‑)verantworten kann. In besonderem Verdacht stehen die als Fibrosarkome bezeichneten Bindegewebetumore, da sie häufig einen sehr großen Umfang annehmen, zum Teil mit einem Gewicht bis zu 20 kg. Ähnliches gilt auch für Karzinome von Lunge, Harnblase, Ovar oder des Magen-Darm-Trakts, die häufig bis zu 9 kg wiegen.
Es gibt zwei Anhaltspunkte dafür, dass der Hefepilz Candida albicans für eine Hypoglykämie (mit‑)verantwortlich sein könnte:
- Hefepilzzellen vermehren sich sehr schnell und entziehen dem Körper schon im Darm Kohlenhydrate.
- Hefepilztoxine werden verdächtigt, die Funktionen der Langerhanszellen zu beeinträchtigen.
Da psychischer Stress auch zu Schädigungen zentralnervöser Regelungsbereiche führen kann ‑ dieses Thema wird noch im Teil B von Kapitel 4 eine Rolle spielen ‑, kann auch durch ihn eine Hypoglykämie mitverursacht werden.
Eine Neigung zur Hypoglykämie könnte auch anlagebedingt ‑ d. h. polygenetisch ‑ mitbegründet sein, vergleichbar mit einem konstitutionell niedrigen Blutdruck.
4.8.7 Symptome und Ursachen des Hypoglykämie-Syndroms
Bisher ging es hauptsächlich um den Kern der Hypoglykämie, also die Ursachen von Entgleisungen der Blutzuckerregelung und damit verbundener Primärsymptome, die durch einen absoluten oder relativen Glukosemangel charakterisiert sind.
Eine Hypoglykämie kann ausschließlich mit diesen beiden Primärsymptomen verlaufen, in vielen Fällen gesellen sich jedoch weitere sekundäre Symptome affektiven oder nicht-affektiven Charakters hinzu, und die Hypoglykämie weitet sich zum Hypoglykämie-Syndrom aus.
Wird Hypoglykämie bei Affektstörungen diagnostiziert, besteht die Gefahr vorschneller Schlussfolgerungen über den Glukosemangel als alleinige Ursache der Affektstörungen. Grund: Patienten haben in der Regel eine jahrelange Odyssee durch zahlreiche Arztpraxen hinter sich, und man ist nun erfreut, endlich den Übeltäter präsentieren zu können.
Die Frage, warum es aufgrund von Glukoseversorgungsproblemen zum Hypoglykämie-Syndrom mit seinen zahlreichen Symptomen kommen kann, ist jedoch komplex und bedarf einer ausführlichen Diskussion, sie kann mit Hilfe des kausaltheoretischen Instrumentariums jedoch plausibel beantwortet werden, was später bei der Suche nach geeigneten therapeutischen Verfahren hilfreich sein wird. Dazu gehört auch die Frage, warum einige Patienten keine oder nur bestimmte Sekundärsymptome entwickeln.
Es werden verschiedene Ursache-Wirkungs-Varianten diskutiert, sowohl kausale und korrelative Zusammenhänge als auch Koinzidenz und die Kausalkettenthematik.
Affektive und nicht-affektive Symptome des Hypoglykämie-Syndroms
Hypoglykämie-Symptome kommen häufig aus dem neurologisch-psychiatrischen Spektrum (→ ausführliche Aufzählung in Abschnitt 4.8.3):
- Gereiztheit bzw. Aggressivität (affektiv)
- Stimmungsschwankungen (affektiv)
- Stimmungstiefs (affektiv)
- Hypomanie (affektiv)
- Angst- und Panikattacken (affektiv)
- Zittern, Tremor (nicht-affektiv/neurologisch)
- Schwindel (nicht-affektiv/neurologisch)
- Unruhe (nicht-affektiv)
- Konzentrationsstörungen (nicht-affektiv/neurologisch)
- Psychosen (nicht-affektiv)
Aber auch rein somatische Symptome werden häufig beobachtet (→ ausführlich Abschnitt 4.8.3):
- Tachykardie (Herzrasen)
- Übelkeit und Erbrechen
- Ekzeme
- Verdauungsprobleme
Kurz- und langfristige Ursache-Wirkungs-Aspekte
Monate oder Jahre andauernd kann Hypoglykämie Folgen haben, die über kurzfristige Auswirkungen weit hinausgehen und den Verlauf eines Hypoglykämie-Syndroms beeinflussen. Daher ist eine zeitlich differenzierende Betrachtung kurz‑ und langfristiger hypoglykämischer Aspekte notwendig.
Die beiden Abbildungen 29a und b veranschaulichen Ursachen affektiver und nicht-affektiver Sekundärsymptome unter kurzfristigen Gesichtspunkten. Aus Vereinfachungsgründen wurde auf die Berücksichtigung der Nebenniereninsuffizienz verzichtet, die tendenziell zur Verschlechterung der Blutzuckerregelung beiträgt, die Darstellung jedoch erheblich verkomplizieren würde.
Kurzfristig resultieren affektive Störungen ‑ insbesondere die Depression ‑ vor allem aus Reaktionen affektrelevanter Gehirnareale auf einen absoluten oder relativen Glukosemangel. Darüber hinaus überwindet das aus Kompensationszwecken sezernierte Cortisol der Nebennierenrinde problemlos die Blut‑Hirn‑Schranke und führt zu einer übermäßigen Hirnnervenzellenaktivierung. Cortisol wirkt tendenziell kurzfristig stimmungsaufhellend und kann sogar eine Hypomanie auslösen. Derartige Effekte sind als Nebenwirkung von Kortisonpräparaten hinlänglich bekannt.
Bezüglich nicht‑affektiver Symptome des neurologisch‑psychiatrischen Symptomspektrums und somatischer Symptome gilt Vergleichbares, denn sie können aus Reaktionen nicht‑affektrelevanter Hirnareale resultieren, die ebenfalls von Glukosemangel und Cortisol betroffen sind.
Cortisol hat darüber hinaus das Potential, direkt auf periphere Organstrukturen einzuwirken und auf diese Weise unabhängig vom Zentralnervensystem rein somatische Reaktionen auszulösen.
Die aus dem Nebennierenmark glukosemangelbedingt sezernierten Körperhormone Adrenalin und Noradrenalin können eine intakte Blut‑Hirn‑Schranke nicht überwinden. Theoretisch kommt es durch diese Substanzen daher nicht zu zentralnervösen Reaktionen, wohl aber zu rein somatischen, da auch sie peripher mit vielen Organen interagieren.
Welche Syptome bei Betroffenen letzlich auftreten, ist abhängig von deren individueller Situation.
Kurzfristige Ursache-Wirkungs-Abfolgen bei Hypoglykämie und Hypoglykämie-Syndrom (Abbildung 29a)
Hypoglykämische Primärursachen bzw. die linke Seite der Kausalkette wurden schon im vorigen Abschnitt 4.8.6 ausführlicher analysiert:
Regelkreis-Dysfunktion → Glukose ▼ → ...
Regelkreis-Dysfunktion + Ernährungsfehler → Glukose ▼ → ...
Regelkreis-Dysfunktion + Exogene Noxen → Glukose ▼ → ...
Das bedeutet: Hypoglykämie im hier verstandenen nicht-diabetischen Sinne bedarf immer eines dysfunktionalen Blutzuckerregelkreises. Ernährung und sonstige internen oder externen (exogenen) Noxen spielen wichtige sekundäre Rollen. So muss eine intakte Blutzuckerregelung auch mit einer in puncto Glukoseversorgung suboptimalen Ernährung zurechtkommen, zumindest wenn die Ernährungsfehler im üblichen Rahmen bleiben (→ Abschnitt 4.8.6).
Die rechte Seite der Kausalkette betrifft Ursache-Wirkungs-Beziehungen sekundärer Hypoglykämie-Symptome aus dem psychiatrisch-neurologischen Spektrum aufgrund direkter Auswirkungen des Glukosemangels auf affektrelevante und nicht-affektrelevante Teile des Gehirns:
... → Affektive Hirnareale → Affektive Symptome
... → Nicht-affektive Hirnareale → Nicht-affektive/Psychiatrische Symptome
... → Nicht-affektive Hirnareale → Nicht-affektive/Somatische Symptome
... → Cortisol ▲ → Affektive Hirnareale → Affektive Symptome
... → Cortisol ▲ → Nicht-affektive Hirnareale → Nicht-affektive/Psychiatrische Symptome
... → Cortisol ▲ → Nicht-affektive Hirnareale → Nicht-affektive/Somatische Symptome
Direkte, nicht zentralnervös gesteuerte Reaktionen von Körperorganen aufgrund der Hormone Cortisol, Adreanlin und Noradreanlin lassen sich folgendermaßen darstellen:
... Cortisol ▲ → Somatische Symptome (peripher)
... Körperhormon Adrenalin ▲ → Somatische Symptome (peripher)
... Körperhormon Noradrenalin ▲ → Somatische Symptome (peripher)
Der Zusammenhang zwischen affektiven und nicht-affektiven bzw. somatischen Symptomen ist kurzfristig immer korrelativ, da sie auf denselben Ursachen eines absoluten und/oder relativen Glukosemangels beruhen. Die Vermutung, nicht-affektive Sekundärsymptome könnten eine Depression auslösen, lässt sich mit diesem Modell nicht belegen.
Allerdings können sowohl affektive als auch nicht-affektive bzw. somatische Symptome kurzfristig zu einer depressiven Verstimmung führen; es besteht damit auch die Möglichkeit, dass Depression und depressive Verstimmungen parallel auftreten.
Sonderfall: Dysfunktionales Hypothalamus-Hypophysen-System (Abbildung 29b)
Darüber hinaus ist diagnostisch zu berücksichtigen, dass mit Hypothalamus und Hypophyse Hirnstrukturen an der Entstehung der Hypoglykämie beteiligt sein können, die den affektrelevanten Hirnarealen zugehörig sind. Daher kann ein dysfunktionaler Hypothalamus oder eine dysfunktionale Hypophyse für bestimmte affektive oder nicht-affektive Symptome auch hypoglykämieunabhängig direkt verantwortlich sein.
In diesem Fall weichen die Ursache-Wirkungs-Beziehungen vom obigen Schema ab. Liegt allen oben beschriebenen Kausalbeziehungen nämlich die Annahme zugrunde, Glukosemangelzustände beruhten hauptsächlich auf ein oder mehreren defekten Regelkreisorganen mit einer Affektstörung als mögliche Folge (linke Seite der Kausalkette ist die Ursache für die Abfolgen auf der rechten Seite), könnte eine Hypothalamus-Hypophysen-Erkrankung nämlich sämtliche Primär- und Sekundärsymptome ‑ also sowohl affektive als auch nicht-affektive Symptome als auch die Hypoglykämie ‑ parallel verursachen. Dann ständen alle Symptome hier in einem korrelativen Verhältnis zueinander (→ Abbildung 29b).
Darüber hinaus sind auch Mischformen denkbar, die sowohl durch kausale als auch korrelative Beziehungen charakterisiert sind.
ABBILDUNGEN 29 A/B: KAUSALE ASPEKTE DES HYPOGLYKÄMIE-SYNDROMS (KURZFRISTIG)
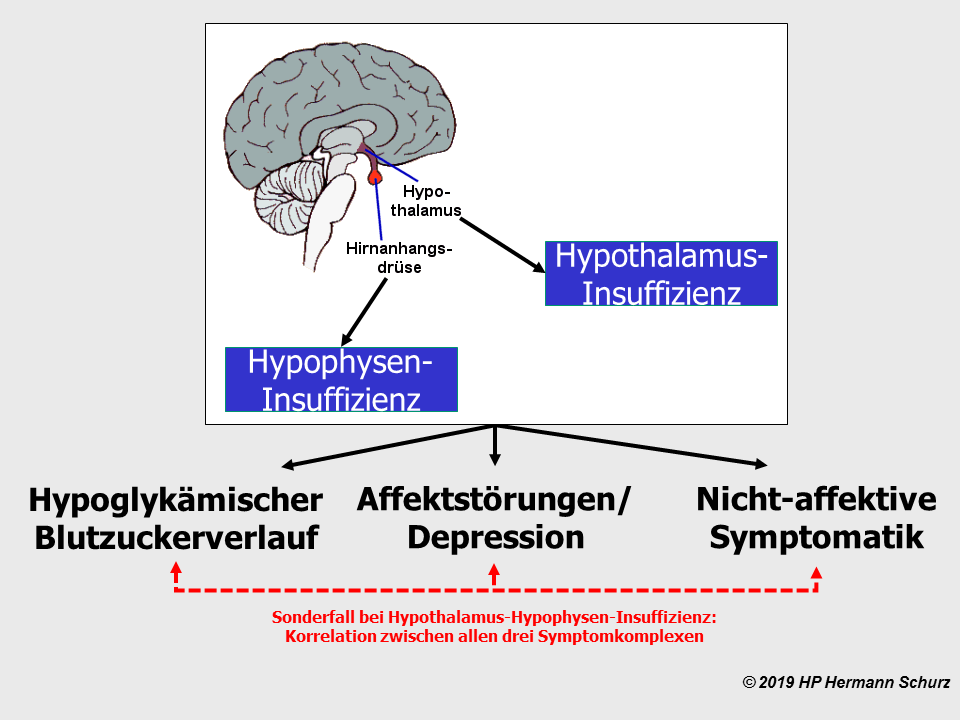
Abbildungen 29a und 29b: Abbildung 29a oben stellt Kausalbeziehungen dar, die in den meisten Fällen zutreffen. Kommt es an einer oder mehreren Stellen im Regelorgansystem (linke Seite der Graphik) zu Fehlfunktionen, kann daraus zunächst ein hypoglykämischer Blutzuckerverlauf resultieren (Unterzucker, Schwankungen des Blutzuckerwertes oder zu schnelles Absinken des Blutzuckerspiegels). Damit sich ein Hypoglykämie-Syndrom mit einer affektiven oder nicht-affektiven Symptomatik entwickelt, bedarf es weiterer Voraussetzungen. So hat die suboptimale Glukoseversorgung eine direkte, ungünstige Wirkung auf das glukoseabhängige Gehirn. Darüber hinaus sind kompensatorische Reaktionen der Nebenieren verantwortlich, mit denen Glukoseversorgungsproblemen entgegengewirkt werden sollen, und die den Körper zunächst mit verschiedenen Stresshormonen fluten (Adrenalin, Noradrenalin und Cortisol). Adrenalin und Noradrenalin erreichen bei intakter Blut-Hirn-Schranke das Gehirn nicht, können aber in den peripheren Organen für somatische Symptome verantwortlich sein. Cortisol, für das die Blut-Hirn-Schanke kein Hindernis darstellt, kann im Gehirn zu affektiven oder nicht-affektiven/somatischen Sekundärsymptomen führen. Sämtliche Sekundärsymptome können (reaktive) depressive Verstimmungen zur Folge haben. Bei dysfunktionalem Hypothalamus-Hypophysen-System könnten Hypoglykäme und Affektstörungen (ggf. auch eine nicht-affektive Symptomatik) auch in einer korrelativen Beziehung stehen, die Hypoglykämie wäre dann nicht hauptsächlich für die Sekundärstörungen verantwortlich, sondern alle Primär- und Sekundärsymptome beruhten auf derselben hirnorganischen Ursache, nämlich einem insuffizienten Hypothalamus-Hypophysen-System. Abbildung 29b stellt diesen Fall dar. Kausal-korrelative Mischfomen sind ebenfalls möglich.
Langfristig kann Hypoglykämie zu massiveren organischen Schädigungen der Nervenzellen führen, denn ständiger absoluter und/oder relativer Glukosemangel stellt für das Gehirn erheblichen Stress dar (→ Abbildung 30). Darüber hinaus werden Nervenzellen auch durch die mit dem ständigen Glukosemangel einhergehende Cortisolbelastung massiv geschädigt.
In der Evolution entwickelte sich der Cortisolmechanismus, um kurzfristig Stressituationen zu parieren. Heute sind diese oftmals chronisch, und eine dauerhafte Überflutung mit dem Stresshormon ist die Folge. Das gilt auch für Menschen, die langfristig einer Hypoglykämie ausgesetzt sind.
Cortisol schädigt sowohl direkt durch seine dauerhaften Zellaktivitäten als auch indirekt aufgrund dadurch bedingter zellulärer Cortisolabbauprozesse, die einen chronisch erhöhten oxidativen Zellstress zur Folge haben. Derartigen Situationen können Nervenzellen auf Dauer nicht standhalten, und es kommt sowohl zu Störungen innerhalb der Nervenzellen als auch zu deren Absterben.
Beide neurologischen Schädigungsmechanismen werden im Abschnitt 4.11 noch thematisiert. Sie können Affektstörungen auslösen oder verstärken und zu ihrer Chronifizierung beitragen. Auch hier beeinflusst die individuelle Situation Betroffener die Entwicklung, also die Frage, ob affektrelevante Hirnregionen un- oder evtl. vorbelastet sind.
Auch die Nebennieren sind durch die glukosemangelbedingte Dauerproduktion von Adrenalin, Noradrenalin und Cortisol über die Maßen gefordert; es besteht langfristig zusätzlich die Gefahr, an einer Nebenniereninsuffizienz zu erkranken. Darüber hinaus wirkt sich die ständige Belastung des übrigen Körpers durch die Nebennierenhormone ungünstig auf betroffene periphere Organe aus und bedeutet einen nicht zu unterschätzenden zusätzlichen Stressfaktor.
ABBILDUNG 30: KAUSALE ASPEKTE DES HYPOGLYKÄMIE-SYNDROMS (LANGFRISTIG)
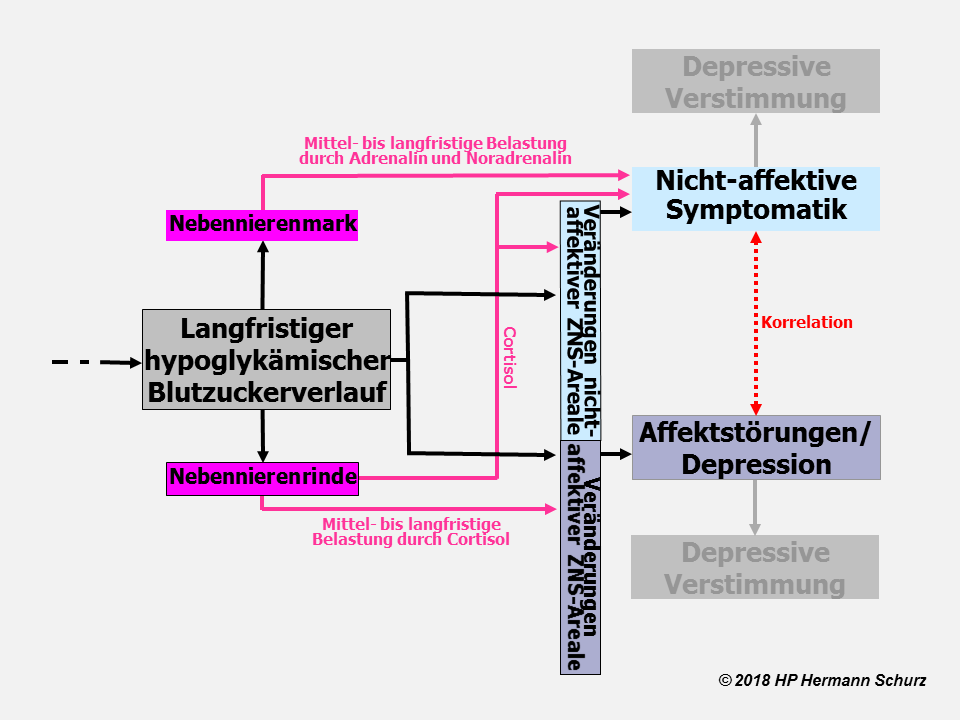
Abbildung 30: Affektive Störungen können (zusätzlich) auch aus einer langfristigen Hypoglykämie resultieren oder sich durch diese verstärken und chronifizieren. Dabei spielen sowohl ständiger Glukosemangel als erheblicher Stressfaktor für das Nervensystem als auch die Wirkungen einer längerfristigen Belastung durch nervenschädigendes Cortisol eine Rolle, das bei Glukosemangel von der Nebennierenrinde ausgeschüttet wird und die Blut-Hirn-Schranke überwindet. Die Auswirkungen von beidem sind umso massiver, je vorbelasteter die betroffenen affektrelevanten Gehirnareale sind.
Koinzidenz von Hypoglykämie und Affektstörungen
Werden Affektstörungen und parallel Hypoglykämie diagnostiziert, muss auch die Möglichkeit einer Koinzidenz beider Merkmale in Betracht gezogen werden. Bei Koinzidenz gibt es zwischen zwei Merkmalen keinerlei Zusammenhänge.
Da aus kausaltheoretischer Perspektive ausschließlich pathologische Reaktionen affektiver Hirnareale für Affektstörungen verantwortlich sind (→ Abschnitt 1.5), kann es für ein Koinzidenz-Szenario nur eine plausible Erklärung geben:
- Interne oder externe Auslöser unterschiedlicher Art verursachen funktionale und/oder degenerative Veränderungen in affektrelevanten Hirnarealen, die zu Affektstörungen führen. Parallel dazu können ein oder mehrere dysfunktionale Regelkreisorgane, Ernährungsfehler und/oder exogene Noxen zu Glukoseversorgungsproblemen (Hypoglykämie) führen. Obwohl auch alle affektrelevanten Hirnbereiche von dem Glukosemangel betroffen sind, kommt es dennoch ‑ aus verschiedenen Gründen ‑ nicht zu Affektstörungen (→ Beispiele A und B).
Beispiel A: Die Depression beruht auf einer Schilddrüsenunterfunktion und/oder einem geschädigten Hypothalamus-Hypophysen-System. Bei der Schilddrüsenunterfunktion ist es der Hormonmangel, der die affektrelevanten Hirnbereiche negativ beeinflusst, in dessen Folge die Depression entsteht. Für die hypoglykämischen Fehlsteuerungen sind demgegenüber Pankreas, Leber, Nierenrinde und/oder Nebenniere zusammen mit Ernährungsfehlern oder exogenen Noxen verantwortlich (→ schwarze Pfeile in Abbildung 31a). Die daraus resultierende Hypoglykämie wirkt sich zwar auch auf affektrelevante Hirnareale aus, hat aber dort keine Konsequenzen für die Reizverarbeitung. Es gibt daher weder einen kausalen noch einen korrelativen Zusammenhang zwischen der Hypoglykämie und den Affektstörungen. Der Grund dafür könnte in unterschiedlichen Reizschwellen des gesamten affektrelevanten Hirnareals liegen, das beispielsweise auf schilddrüsenbedingte hormonelle Defizite stark negativ mit Affektstörungen reagiert und weniger bzw. gar nicht auf Glukoseengpässe. Eine alternative Erklärung könnte in verschiedenen Zuständen von Teilbereichen innerhalb des affektiven Gesamtareals liegen; der für die Verarbeitung von Schilddrüsenhormonen zuständige Teilbereich reagierte dann sensibler auf Veränderungen der für ihn notwendigen Substanzen, was an seinen schon fortgeschrittenen degenerativen neuronalen Veränderungen liegen könnte. Mit Glukoseengpässe hätte dieser und auch alle anderen affektrelevanten Hirnareale keine Probleme.
Beispiel B: Bestimmte affektrelevante Areale des Zentralnervensystems außerhalb von Hypothalamus und Hypophyse, beispielsweise Assoziationsareal, Gyrus cinguli, Hippocampus/Fornix, Amygdala, Thalamus, Epiphyse oder das Mittelhirn, verursachen unabhängig von anderen exogenen Einflüssen aufgrund autonomer degenerativer neuronaler Veränderungen eine Affektstörung. Parallel kann eine Hypoglykämie für Affekte dennoch völlig folgenlos aufgrund von Funktionsstörungen der Regelkreisorgane, einer ungünstigen Ernährungsweise oder anderen exogenen Noxen entstehen (→ schwarze Pfeile in Abbildung 31b). Die im Beispiel A gemachten Erklärungen unterschiedlicher Reaktionen träfen auch hier zu.
Die Situationen können sich langfristig ändern, beispielsweise wenn der degenerative Prozess weiter anhält. Eine solche Entwicklung wird im 3-Stufen-Modell beschrieben (→ Kapitel 1.4). Mit einer kontinuierlich degenerativen Verschlechterung der Reizverarbeitung führten auch chronische Glukoseengpässe irgendwann zu Affektstörungen. Dazu kommt, dass gerade Glukosemangel langfristig selber degenerative organische Veränderungen auf neuronaler Ebene folgen und im Laufe der Zeit zur Affektstörung beisteuern. Die Affektstörungen könnten jetzt auf zwei verschiedene Ursachen zurückzuführen sein (→ dunkelrotgestrichelte Pfeile in den Abbildung 31a und 31b), nämlich eine hypoglykämieunabhängige und eine hypoglykämiabhängige. Die so entstandene unübersichtliche Gemengelage ließe eine exakte Analyse der Zusammenhänge nicht zu.
ABBILDUNGEN 31 A/B: KOINZIDENZ BEI AFFEKTSTÖRUNGEN UND HYPOGLYKÄMIE
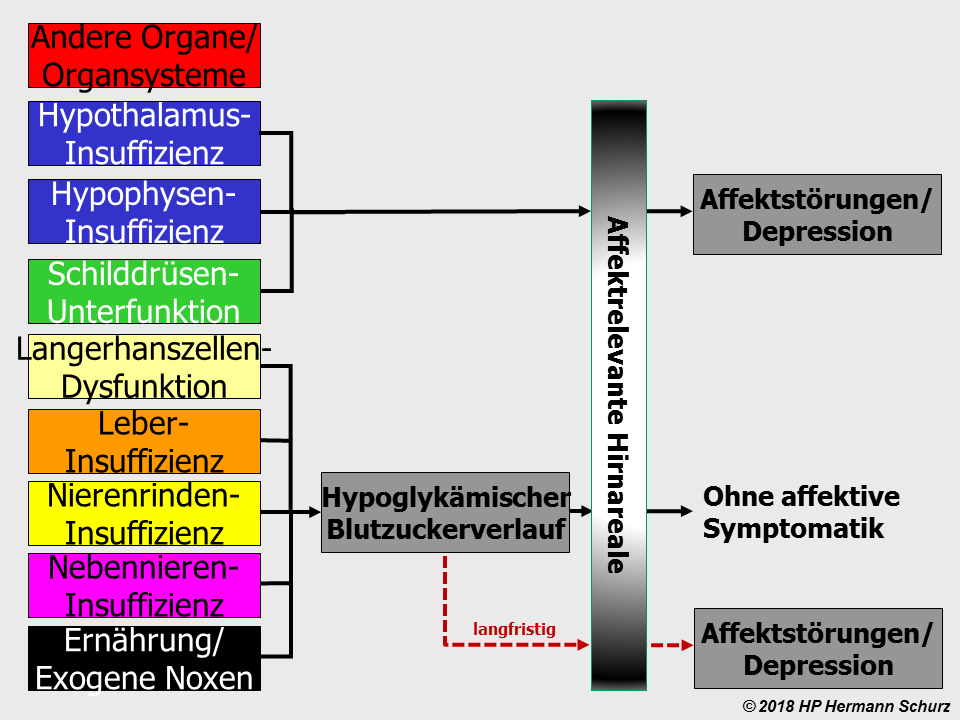
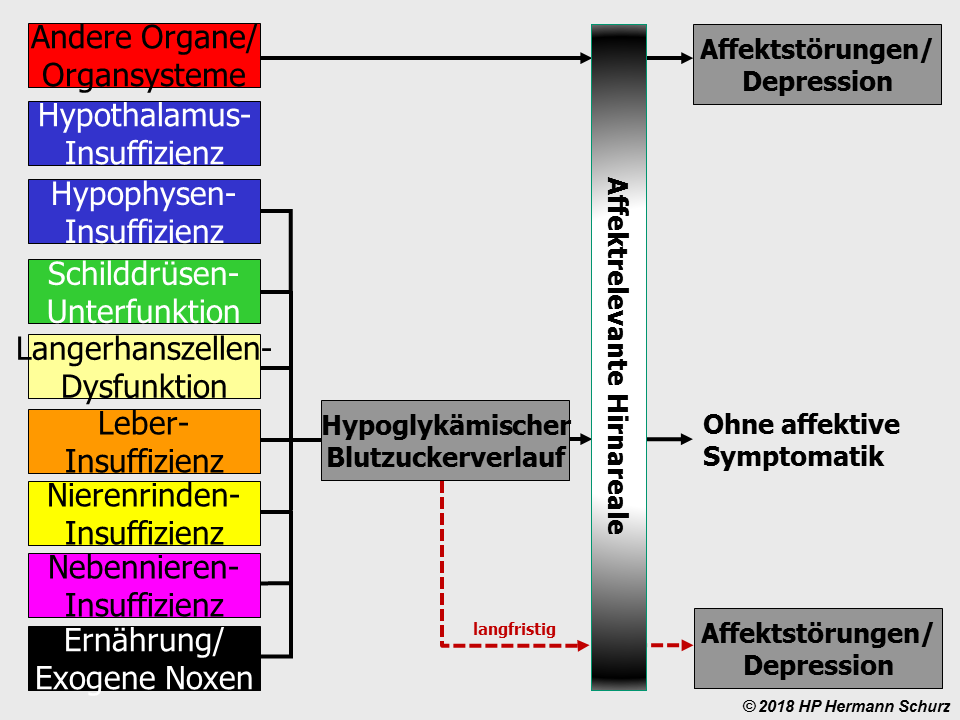
Abbildungen 31a und 31b: Zwei Beispiele, in denen Affektstörungen und Hypoglykämie kurz- bis mittelfristig völlig unabhängig voneinander sind. Langfristig zunehmende degenerative neurologische Veränderungen der affektrelevanten Hirnareale verändern die Situationen grundlegend.
Korrelation zwischen Hypoglykämie und Affektstörungen
Dass Hypoglykämie und Affektstörungen auch lediglich korrelativ auf dieselben Ursache zurückzuführen sind, beispielsweise auf eine Hypothalamus-Hypophysen-Insuffizienz, wurde schon weiter oben diskutiert (→ Abbildung 29b):
- Eine Korrelation zwischen Hypoglykämie und Affektstörungen liegt vor, wenn beides ohne jegliche Ursache-Wirkungs-Beziehung ausschließlich auf derselben Ursache beruht, und die Affekterkrankung von hypoglykämischen Effekten weder ausgelöst noch verstärkt wird. Affekterkrankung und Hypoglykämie sind hier zwei Seiten einer Medaille.
Beispiel A (→ Abbildung 32a) entspricht dem in Abbildung 29b gezeigeten Szenario in einer alternativen Darstellung unter zusätzlicher Berücksichtigung langfristiger Effekte. Die Affektstörung beruht auf einem dysfunktionalen Hypothalamus-Hypophysen-System, dem schädigungsbedingt auch die Glukoseregelung entgleist, ohne dass die daraus resultierenden Glukoseversorgungsengpässe Affektstörungen auslösen oder verstärken.
In Beispiel B (→ Abbildung 32b) sind Probleme von am Glukoseregelsystem beteiligten peripheren Organen sowohl für Hypoglykämie als auch.für Affektstörungen verantwortlich. Die Hypoglykämie hat keine Auswirkungen auf die Gemütslage.
Es ist schwierig bis unmöglich, Korrelationen eindeutig zu erkennen. Bleiben Affektstörungen von Glukosespiegelabfällen auch kurzfristig unbeeinflusst, was zum Beispiel diagnostisch mit Hilfe eines Glukosetoleranztests getestet werden könnte (→ Teil II, Kausale Therapien), ist ein korrelativer Zusammenhang eine mögliche Erklärung. Es könnte aber genauso eine Koinzidenz vorliegen, bei der Hypoglykämie und Affektstörung völlig unabhängig voneinander auf unterschiedlichen Ursachen beruhen. Für eine Korrelation spräche, wenn beide Symptome zum gleichen Zeitpunkt erstmals aufgereten sind, aber auch das ist keine ausreichende Bedingung.
Bei der Diskussion direkter Ursache-Wirkungs-Beziehungen zwischen Glukosemangel und Affektstörungen wurde schon darauf verwiesen, dass auch eine Kombination von Korrelation und Kausalität möglich ist. Eine solche könnte sich langfristig entwickeln, da ständige Glukoseengpässe zu neurodegenerativen Prozessen führen können, die zusätzlich Affektstörungen triggern (→ langfristiger Effekt in den Abbildungen 32a und 32b).
ABBILDUNGEN 32 A/B: KORRELATION UND KORRELATION-KAUSALITÄT IN KOMBINATION
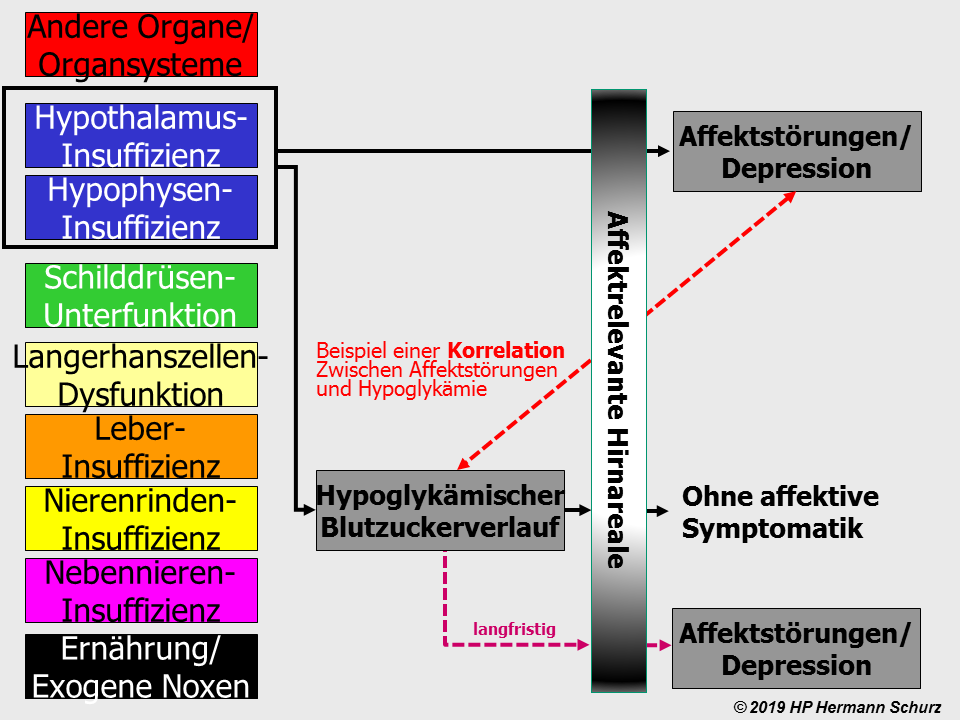
Abbildung 32a und 32b: Eine Korrelation zwischen Hypoglykämie und Affektstörungen beruht auf deren paralleler Verursachung durch dasselbe dysfunktionale Organsystem, ohne dass Ursache-Wirkungs-Beziehungen zwischen beiden Merkmalen existieren. Langfristig kann die Hypoglykämie zusätzliche neurodegenerative Veränderungen zur Folge haben, die nach und nach zu einer Verstärkung affektiver Symptome beitragen und das zunächst rein korrelative Szenario verändern.
Quintessenz: Kausaltheoretische Begründungen komplexer Ursache-Wirkungs-Beziehungen
Zusammenfassend die Gründe zweier gegensätzlicher Reaktionen ‑ Affektstörungen auf der einen, keine Affektstörungen auf der anderen Seite ‑ bei Hypoglykämie.
Neben vielen Faktoren, die zur Hypoglykämie führen ‑ also Einflüssen des komplexen Regulationssystems mit zahlreichen Organen, Ernährungsgewohnheiten und weiteren internen oder externen Auslösern ‑, spielt der individuelle Zustand affektrelevanter Gehirnareale die wesentliche Rolle (Primärebene). Affektstörungen werden umso zahlreicher und stärker wahrgenommen, je vorbelasteter bzw. geschädigter diese sind. Umgekehrt gilt: Je unbelasteter, desto besser werden die Areale mit einem Glukosemangel zurechtkommen. Daher kann eine Hypoglykämie in einigen Fällen auch komplett ohne Sekundärsymptome verlaufen (→ 3‑Stufen‑Modell in Kapitel 1).
Auch die Stärke des Glukosemangels spielt vermutlich eine wichtige Rolle: Je ungünstiger der Glukosekurvenlauf, desto stärker und/oder komplexer die Symptome bei entsprechend vorgeschädigtem Nervensystem. Das betrifft beispielsweise die Sinkgeschwindigkeit nach dem Höchststand, die Tiefe des Glukosewertes bzw. die Dauer seines Tiefstands und die Intensität, Anzahl und Dauer von Kurvenverlaufsschwankungen oder das ein- oder mehrfache Unterschreiten des Nüchternzuckerwerts.
Beispiele verschiedener Symptomintensitäten von leicht bis schwer:
- Reizbarkeit - Aggressivität
- Ruhelosigkeit - Überaktivität/Hypomanie - Manie
- Leichte / Mittelgradige / Schwere / Schwerste Depression
- Leichte / Mittelgradige / Schwere Stimmungsschwankungen bei Bipolarer Störung
- Entschlusslosigkeit - Gleichgültigkeit - Lethargie
- Unsicherheit - Ängste - Phobien/Panikattacken
Die Frage nach Ursachen der Verschiedenartigkeit von Symptomen, also der Symptomcharakteristik, ist ebenfalls anhand des kausaltheoretischen Modells gut nachzuvollziehen: Die Symptomart hängt vor allem davon ab, wie das für diese bestimmte Teilfunktionen zuständige Hirnareal oder System den Glukosemangel verkraftet (→ Funktionsmodell in Abschnitt 1.3.2). Aus dieser Individualiät resultiert letztlich die große Symptomvielfalt und den im Einzelfall großen Unterschieden.
All das, was für affektive Symptome gilt, kann auch auf nicht‑affektive neurologisch‑psychiatrische Symptome übertragen werden. Hier gilt gleichermaßen, dass die Charakteristik derartiger Symptome vom Zustand der betreffenden nicht‑affektrelevanten Hirnareale abhängt.
4.8.8 Diabetische und nicht-diabetische Hypoglykämie in Empirie und Erfahrungsheilkunde
Von der Möglichkeit hypoglykämischer Blutzuckerwerte, die nichts mit einem Diabetes mellitus zu tun haben, weiß man spätestens seit dem Jahre 1924. In diesem Jahr veröffentliche Seale Harris, ein englischer Arzt aus Birmingham, einen Fachbeitrag über seine Patientenerfahrungen mit verschiedenen Fällen spontanen Hyperinsulinismus' von Nicht-Diabetikern (Quelle: Seale Harris M. D., Hyperinsulinism and disinsulinism, Journal of the American Medical Association 1924, Vol. 83, S. 729 ‑ 733, http://jama.jamanetwork.com/...).
Obwohl seither regelmäßig Schriften sowohl in Fachkreisen als auch in populärwissenschaftlichen Medien über das Thema erscheinen und auch erfahrungsmedizinisch die Existenz der nicht-diabetischen Hypoglykämie als ernsthafte Erkrankung auch mit psychiatrischen Symptomen nicht mehr zu bestreiten ist, erfolgte bis heute keine Klassifizierung in den internationalen statistischen Klassifikationen ‑ weder im ICD‑10‑Verzeichnis der WHO noch im US-amerikanischen DSM‑Verzeichnis spielt die nicht‑diabetische Form der Hypoglykämie eine Rolle. Die WHO erwähnt zwar unter der Ziffer E16 einige Codes für Hypoglykämie, jedoch nur im Zusammenhang mit Pankreaserkrankungen.
Da wundert es niemanden, dass auch kaum Untersuchungen zu den Ursachen und generellen Auswirkungen der nicht-diabetischen Hypoglykämie betrieben werden. Obwohl die Gehirntätigkeit wesentlich von seiner Glukoseversorgung mitbestimmt wird und Glukoseversorgungsprobleme damit zwangsläufig auch zu Symptomen führen müssen, ist die Erkrankung bis heute so gut wie nicht erforscht.
Da hingegen diabetische Hypoglykämien aufgrund von Insulinfehldosierungen ein großes Problem in der Therapie gegen Diabetes mellitus darstellen, gibt es hierüber glücklicherweise eine Reihe von Forschungsergebnissen, deren Aussagen zum Teil auf die nicht-diabetische Form übertragbar sind.
Im Unterschied zum insulinüberdosierten Diabetiker sind Dauer und Abfall der Glukosewerte bei nicht-diabetisch unterzuckerten Patienten im Durchschnitt zwar geringer, jedoch sind auch hier im Einzelfall vergleichbar starke Unterzuckerungen möglich. Darüber hinaus sind auch die langen Zeiträume zu berücksichtigen, bis eine derartige Problematik ‑ wenn überhaupt ‑ erkannt wird, so dass sich das negative Potential einer hohen Anzahl geringerer Glukosetiefstände im Laufe der Zeit zu einem hohen Gesamtschaden summieren kann.
Schriften und Forschungen über allgemeine Aspekte nicht-diabetischer Hypoglykämie
Bei den von Seale Harris 1924 erstmalig beschriebenen Symptomen (Quelleangabe → oben) handelte es sich jedoch ausnahmslos um nicht-affektive Auffälligkeiten, beispielsweise Heißhungerattacken, Nervosität, Erschöpfung oder Zittern, über Stimmungsveränderungen berichtet er nichts. Harris stellte schon damals fest, dass Blutzuckerwerte unterhalb von 70 mg/dl problematisch sind: „It therefore seemed probable that, since hypoglycemia is the result of hyperinsulinemia, a study of the blood sugar in patients who have symtoms of hyerinsulinism should show readings of below 0.007 (70 mg. per hundred cubic centimeters of blood).“.
Der österreichische Neurologe Josef Wilder veröffentlichte im März 1930 in der Deutschen Zeitschrift für Nervenheilkunde einen umfangreichen Fachartikel. Seinen Beitrag leitete er folgendermaßen ein: „Das Verständnis vorstehender Ausführungen hat eine Voraussetzung: die Kenntnis derjenigen Zustandsbilder, die im Gefolge der artefiziellen (Insulin‑) und der sogenannten spontanen Hypoglykämie auftreten können und welche, obwohl fast zur Gänze auf dem Gebiet des Nervensystems und der Psyche sich abspielend und von höchstem Interesse für das Fach der Nervenheilkunde, bisher noch nicht Allgemeingut der Neurologen geworden sind.“ (Quelle: Dr. Josef Wilder, Nervenheilanstalt Maria‑Theresienschlössel, Wien, Ein neues hypophysäres Krankheitsbild: Die hypophysäre Spontanhypoglykämie, Deutsche Zeitschrift für Nervenheilkunde, März 1930, Nr. 112, Ausgabe 4 ‑ 6, S. 192 ‑ 250, https://link.springer.com/article/...).
Man muss sich bewusst machen, dass dieser Fachartikel vor fast 90 Jahren im deutschsprachigen Raum erschien. Wilder vermutete nicht nur Zusammenhänge zwischen Hypoglykämie und zentralnervösen Steuerungsproblematiken bzw. psychischen Auffälligkeiten, er kritisierte auch schon damals, dass die Spontanhypoglykämie kaum Aufmerksamkeit von Seiten der Nervenheilkundlern erhielt. Wilder verwendete für die Erkrankung als erster den Begriff der „spontanen Hypoglykämie“.
In den 1950er Jahren beschäftige sich unter anderem der angesehene amerikanische Endokrinologe J. W. Conn mit der nicht-diabetischen Hypoglykämie, was zwar sehr erfreulich war, jedoch schätzte er aus unerklärlichen Gründen den Grenzwert bedauerlicherweise auf 40 mg/dl und somit um 30 mg/dl niedriger als Seale Harris. Conns hohe Reputation hat dann dazu geführt, dass der niedrigere Wert ungeprüft übernommen wurde und der von Harris geschätzte Wert in Vergessenheit geriet mit unüberschaubar negativen Folgen für die Diagnostik, denn von diesem Zeitpunkt an fielen die meisten Betroffenen durch das Raster und eine nicht-diabetische Hypoglykämie wurde bei Patienten mit Blutzuckerwerten höher als 40 mg/dl fälschlicherweise nicht mehr in Betracht gezogen. So verwendeten die wenigen Fachleute, die sich überhaupt mit dem Phänomen auseinandersetzten, auch noch einen völlig unbrauchbaren Grenzwert. Auch das trug zur weiteren Marginalisierung der Erkrankung in Forschung und Lehre bei (→ ergänzend Abschnitt 4.8.2 über die Grenzwertproblematik und die Whipple-Trias).
Einige Mediziner waren trotzdem immer noch überzeugt, dass auch wesentlich höhere Glukosewerte relevant sind. So bezeichnet der Internist Erich Grafe in der 1958 bei Springer erschienenen zweiten Auflage seines Standardwerks „Ernährungs- und Stoffwechselkrankeiten und ihre Behandlung“ sogar schon Werte unter 80 mg/dl als verdächtig: „(...) In weit selteneren Fällen kann es aber auch zu einer Überfunktion der Inselzellen kommen, zu einer Hypoglykämie. Wir sprechen von einer solchen dann, wenn die Blutzuckerwerte unter 80 mg‑% absinken.“.
Darüber hinaus wiesen mehrere Fachleute nach, dass Conns Wert von 40 mg/dl (2,2 mmol/) zu niedrig ist (Quellen: Sidney Portis, Maximilian Fabrycant, Stephan Gyland, Harry M. Salzer, M. Buehler, Hinweis aus: Michael Martin, Das Hypoglykämie-Syndrom, Ralf Reglin Verlag, 1. Auflage, Köln 1996, Seite 9 f.).
Doch Conns fehleingeschätzter Grenzwert wird leider bis heute verwendet. Der aktuelle, offizielle und häufig zitierte Wert liegt mit 50 mg/dl (2,8mmol/l) nur um 10 mg/dl höher als Conns Wert (→ Abschnitt 4.8.2 über die Grenzwertproblematik und die Whipple-Trias).
Über seine Grenzwerterkenntnisse hinaus nennt Erich Grafe in seinem Werk schon sehr differenziert verschiedene Ursachenkategorien: physiologische Gründe, Unterernährung, Erkrankungen der Leber, des Pankreas und des Magens, innersekretorische Störungen, Nervenleiden und exogene Auslöser für die Entstehung einer nicht-diabetischen Hypoglykämie.
Erich Grafes oben zitierter Einschätzung, dass diese Fälle eher selten sind, muss jedoch widersprochen werden. So schrieb der Internist Friedrich Meythaler schon 1944, dass der Anteil von Menschen mit Problemen aufgrund nicht-diabetischer Hypoglykämie, die auch er als Spontanhypoglykämie bezeichnet, sehr viel höher ist: „Mit Recht wird so die zu bejahende Frage aufgeworfen, ob nicht hypoglykämische Zustände vielleicht häufiger, als man gemeiniglich annimmt, vorkommen. Wie schon aus der beigegebenen dispositionellen Übersicht hervorgeht, gibt es tatsächlich zahlreiche ursächliche Momente für hypoglykämische Zustände. Sehr viel nichterkannte Hypoglykämien sind als Begleitsymptome physiologischer Umstellung des Organismus aufzufassen, (...)“ (Quelle: Direktor Prof. Dr. F. Meythaler, Medizinische Poliklinik Erlangen, Über Spontanhypoglykämie, Deutsche Medizinische Wochenschrift Nr. 5/6, Februar 1944, https://www.thieme-connect.com/...).
1966 veröffentliche Meythaler seine Ansicht, dass der Anteil der Bevölkerung mit Spontanhypoglykämie ca. 15% beträgt (Quelle: Meythaler, Der hypoglykämische Symptomenkomplex im Straßenverkehr, Therapie der Gegenwart 105, 810/1966).
Forschungen und Studien über Zusammenhänge zwischen Hypoglykämie und Nervenschädigungen
In der Diabetologie wird seit der Entdeckung des Insulins diskutiert, ob, wie und wo eine diabetische Hypoglykämie im Laufe der Zeit Nervenschäden verursacht, denn dann könnten langfristig Nervenerkrankungen entstehen oder verstärkt werden, unter anderem auch eine Affektstörung. Das würde die hier vertretenen Thesen (→ Abschnitt 4.8.7) stützen, unter anderem die Vermutung, dass sich affektive Symptome im Laufe der Zeit durch Hypoglykämie potentiell intensivieren.
In mehreren Untersuchungen diabetischer Hypoglykämien wurden Nervenaktivitätsveränderungen festgestellt: „Eine akute Hypoglykämie führt im EEG zu einer allgemeinen Verlangsamung mit Abnahme von Alpha-Aktivität und Zunahme niedrigfrequenter Aktivität in Form von Theta- und Delta-Wellen (...).“ (Quelle: Claudia Runde, Schwere Hypoglykämien bei Kindern und Jugendlichen mit Diabetes mellitus Typ 1: Einfluß auf die körperliche und psychomentale Entwicklung, Medizinisches Zentrum für Kinderheilkunde und Jugendmedizin, Gießen 2001, http://bibd.uni-giessen.de/...).
Ob bzw. wie sich ungünstige Nervenaktivitätsveränderungen nach einer bestimmten Zeit verstärken und/oder chronifizieren, hinge nach diesen Forschungsergebnissen von mehreren Faktoren ab, insbesondere von der Dauer der Erkrankung und der Tiefe der Glukoseabfälle. Daraus könnten dann auch Schäden resultieren, die denen der Stufen 2 und 3 des 3-Stufen-Modells entsprechen (→ Abschnitt 1.4) und mit einem Abbau von Neuronenverbindungen und Zelltod verbunden sind. Es ist möglich, dass sich ein über mehrere Jahre bestehendes und unbehandeltes Hypoglykämie-Syndrom gravierend auswirkt und beispielsweise ein Hirnorganisches Psychosyndrom (HOPS) zur Folge hat.
Zu diesem Thema führt Michael Martin aus: „Rezidivierender Glucosemangel führt zu Summationseffekten insbesondere auch im Bereich der Gehirnfunktion. Es kommt zu Wesensveränderungen, zu einer Einschränkung intellektueller Fähigkeiten, zu einer allgemeinen Verlangsamung. Somit kann sich ein irreversibles organisches Psychosyndrom entwickeln. Neurologische Krankheitsbilder wie Lähmungserscheinungen und sogar bestimmte Formen des Muskelschwunds (spinale Muskelatrophien) können als Folge ständiger Unterzuckerungszustände auftreten. Solche Komplikationen sind in der Regel bei schweren rezidivierenden Hypoglykämien zu erwarten.“ (Quelle: Michael Martin, Das Hypoglykämie-Syndrom, Ralf Reglin Verlag, 1. Auflage, Köln 1996).
Verschiedene Untersuchungen kommen zu dem Ergebnis, dass Hypoglykämien mit größeren ZNS‑Schäden einhergehen.
Eine Langzeitstudie mit 16.667 älteren Diabetes‑2‑Patienten aus Kalifornien/USA, die zwischen 1980 und 2007 durchgeführt wurde, bestätigte eine Erhöhung der Demenzrate bei Patienten, die unter mindestens einer schweren Hypoglykämie gelitten hatten. (Quelle: Rachel A. Whitmer et al., Hypoglycemic Episodes and Risk of Dementia in Older Patients With Type 2 Diabetes Mellitus, Division of Research, Section and Prevention, Kaiser Permanente Medical Center, Oakland/California, Departments of Psychiatry, Neurology and Epidemiology, University of California, San Francisco, http://jama.jamanetwork.com/...).
Über die Auswirkungen von Hypoglykämien geringerer Stärke konnte die Untersuchung von Whitmer et al. leider keine Aussage machen. Nichtsdestotrotz haben Diabetiker im Laufe ihres Lebens mit einer hohen Anzahl geringerer Hypoglykämien zu kämpfen. Es wird geschätzt, dass Typ‑1‑Diabetiker im Schnitt 1.000 leichtere Hypoglykämien während ihres Lebens bewältigen müssen. Die Anzahl leichter Hypoglykämien ist bei Typ‑2‑Diabetikern im Schnitt etwas geringer.
Nervenschädigungen durch Unterzuckerungen beruhen nicht nur auf dem unmittelbaren Glukosemangel, auch sekundäre Noxen kommen infrage. Vor allem Schäden der Stufen 2 und 3 (→ 3‑Stufen‑Modell) können auf Prozessen basieren, die durch Hypoglykämie erst ausgelöst werden, zum Beispiel auf einem permanent hohen Cortisolspiegel (→ Abbildung 30 oben).
Ebenfalls sind neben einem hohen Cortisolspiegel weitere Hypoglykämie-getriggerte Noxen denkbar, die zu neurologischen Schäden im Gehirn führen. So werden in Clauda Rundes oben zitierter Untersuchung der Universität Gießen als sekundäre Ursachen auch Epilepsie, kardiorespiratorische Ursachen oder Toxine genannt. Auf Zusammenhänge zwischen Hypoglykämie und Gehirnschäden bei Diabetes mellitus Typ 1 wird hingewiesen. Es werden mehrere Studien mit positiven Ergebnissen zitiert (Quelle: Claudia Runde, Schwere Hypoglykämien bei Kindern und Jugendlichen mit Diabetes mellitus Typ 1: Einfluß auf die körperliche und psychomentale Entwicklung, Medizinisches Zentrum für Kinderheilkunde und Jugendmedizin, Gießen 2001, http://bibd.uni-giessen.de/...).
So konnten in verschiedenen Tierexperimenten mit Ratten Hirnatrophien bzw. Zellnekrosen nachgewiesen werden, wenn die Tiere zuvor schweren Hypoglykämien ausgesetzt wurden. Die Form der Nekrosen wurden mikroskopisch auch von solchen unterschieden, die durch Ischämie bzw. Anoxie, das heißt Durchblutungsstörungen oder Sauerstoffmangel, ausgelöst wurden, was auf Unterschiede in der Pathogenese hinweist. Die Schädigungen beruhten hier wahrscheinlich nicht nur auf niedrigen Blutzuckerwerten, sondern primär auf zellphysiologischen Folgen bei Isoelektrizität im EEG (→ auch: Lexikon der Neurowissenschaft: Stoffwechselkrankheiten im Gehirn, Spektrum der Wissenschaft Verlagsgesellschaft mbH, Heidelberg, https://www.spektrum.de/lexika/...).
Interessant ist, dass bei den Tieren bestimmte Hirnregionen in besonderem Maße betroffen waren. Neben dem Cortex waren das die Hippocampi und der Nucleus caudatus gemeinsam mit dem Putanem, die zusammen das Corpus striatum der Stammganglien bilden. Beide Hirnregionen haben für die Entstehung von Affekten eine große Bedeutung (→ Abschnitt 1.3.2).
Die Sensibiltät der Hippocampi auf Unterzuckerungen ist in der Medizin aber nichts Neues. So führt Thorsten Süß in seiner Disseration aus: „Der amerikanische Neuropathologe Arthur Weil war einer der wenigen Forscher jener Zeit, der nach Experimenten an Kaninchen das größte Ausmaß der Schädigung im Hippokampus (besonders im Gyrus dentatus) vermutete (Weil et al. 1938).“ (Quelle: Thorsten Süß, Zusammenhänge zwischen kognitiven Defiziten und rezidivierenden Hyperinsulinämien mit konsekutiven, moderaten Hypoglykämien bei Typ-1-Diabetikern mit intensivierter Insulintherapie, 2008, Neurologische Klinik des Zentrums Neurologische Medizin der Medizinischen Hochschule Hannover, https://www.deutsche-digitale-bibliothek.de/...).
Das führt nun von den Tierversuchen zu Untersuchungen an Menschen, denn dort zeigten die gleichen Areale ebenfalls Zellschädigungen nach einem hypoglykämischen Koma bzw. mehreren Komata (Quelle für alle folgenden Beispiele dieses Unterabschnitts: Claudia Runde, Gießen 2001, wie oben).
Bei nach Hypoglykämie Verstorbenen fand man Nekrosen auch in den Hirnarealen Hirnstamm, Thalamus und Kleinhirn, die jedoch nicht eindeutig den Hypoglykämien zugeordnet werden konnten. Das Mittelhirn als oberer Teil des Hirnstamms und der Thalamus als Teil des Zwischenhirns sind beide affektrelevant, das Kleinhirn jedoch nicht.
In anderen Untersuchungen wurden bei erwachsenen Typ-1-Diabetikern Cortex‑Atrophien festgestellt, bei Kindern Hemiparesen und Aphasien, was auf Hirnschädigungen hinweist.
Als Primärursache werden auch Krampfanfälle diskutiert, die häufig mit Hypoglykämien einhergehen, und hypoglykämie-bedingte kardiorespiratorische Ursachen, beispielsweise aufgrund von Fehlatmungen.
Im Rahmen einer Forschungsarbeit fand man heraus, dass Zellschädigungen bei Hypoglykämie auch toxischen Ursprungs sein können, was nochmals die in Abbildung 30 dargestellte These stützt: „Der pathogenetische Mechanismus der Zellschädigung bei schweren Hypoglykämien beruht auf der Bildung von Excitotoxinen, also Neurotoxinen mit excitatorischen Eigenschaften (...), die als Aspartat und Glutamat identifiziert wurden. Diese Aminosäuren werden bei einer Hypoglykämie vermehrt gebildet. Sie stimulieren NMDA-Rezeptoren der Neuronen (...), was zu einer verlängerten Zell-Depolarisation und zu einem Calcium-Einstrom in die Zelle führt. Es erfolgt eine Aktivierung von Lipasen und Proteasen und schließlich eine Zellschädigung (...).“.
Berichte und Studien über Zusammenhänge zwischen Hypoglykämie und Affektstörungen
Ängste und Depressionen als Teil des Hypoglykämie-Syndroms wurden schon relativ früh geschildert. Darauf verweist der Neurologe Josef Wilder in seinem schon oben zitierten Fachartikel vom März 1930. Obwohl er bei seinen Patienten selbst keine affektive Symptomatik bemerkte, schrieb er: „Vom affektiven Standpunkt möchten wir erwähnen, daß wir die häufig geschilderte Angst und Depression bei unseren Fällen nicht ausgeprägt fanden (Sendrail c. s. SH, Finney c. s. SH, Lichtwitz IH, Grevenstuk c. s. IH, Fletcher c. s. IH).“ (Quelle: Dr. Josef Wilder, Nervenheilanstalt Maria‑Theresienschlössel, Wien, Ein neues hypophysäres Krankheitsbild: Die hypophysäre Spontanhypoglykämie, Deutsche Zeitschrift für Nervenheilkunde, März 1930, Nr. 112, Ausabe 4 ‑ 6, S. 192 ‑ 250, https://link.springer.com/...). Es ist bei Wilders Hinweisen jedoch nicht klar, ob die Beschreibungen depressive Verstimmungen oder eine echte Depression betreffen.
Der ebenfalls schon zitierte Internist Friedrich Meythaler beschrieb 1941 einen Fall von Spontanhypoglykämie und affektiven Symptomen bei einer 46-jährigen Patientin mit einer Hypophysenerkrankung und erörterte verschiedene Möglichkeiten kausaler Zusammenhänge, ohne sich auf eine bestimmte Sichtweise festzulegen: „Auch die psychischen Symptome der Patientin im anfallsfreien Stadium, die als Senkung des allgemeinen psychischen Energieniveaus im Sinne des Stertzschen Hypophysenzwischenhirnsyndroms bezeichnet werden können, eine gewisse Einengung des Gefühlslebens, ihre heitere Verstimmung bei flacher Euphorie ‑ die tiefen Blutzuckerwerte sind ihr immer schon vom Gesicht abzulesen ‑, die auffallende Kritik- und Gedächtnisschwäche, die Neigung zur Ideenflucht, der gesteigerte Rededrang bei gleichzeitigem Mangel an Konzentrationsvermögen, lassen sich vielleicht als hypophysär-mesenzephal auffassen. Dabei muß die Frage offenbleiben, ob die Hypophysenzwischenhirnläsion die Folge des primären Funktionsausfalls des Hypophysenvorderlappens und der damit verbundenen Störung der hormonalen Korrelation zwischen Hypophysenzwischenhirn und endokrinem System ist, oder ob auch und wieweit sekundär durch die Hypoglykämie erst gesetzte zentrale Veränderungen (Bodechtel) an der Entstehung der Hypophysenzwischenhirnläsion beteiligt sind.“ (Quelle: Prof. Friedrich Meythaler, Spontanhypoglykämie und Hypophyse, Deutsche Medizinische Wochenschrift, 16. April 1941, S. 433 - 437, https://www.thieme-connect.com/...).
Eine Tierversuchsstudie aus dem Jahre 2012 untersuchte mit einer Depression vergleichbares Verhalten von Mäusen unter dem Einfluss einer Hypoglykämie (Quelle: Min Jung Park et al., Acute hypoglycemia causes depressvie-like behaviors in mice, Metabolism, 2/2012, 61 (2), S. 229 - 236, http://www.ncbi.nlm.nih.gov/...). Die Glukosewerte der Tiere wurden nach mehrstündigem Fasten und einer Insulininjektion für 45 Minuten auf 50 mg/dl abgesenkt, um sie danach innerhalb von etwa 2 Stunden wieder auf den Normalwert steigen zu lassen. Die Mäuse zeigten selbst 24 Stunden nach Abklingen der Hypoglykämie eine depressive Symptomatik, beispielsweise Unbeweglichkeit. Nach 48 Stunden waren alle Symptome verschwunden. Da ein Zusammenhang mit Adrenalin bzw. Noradrenalin vermutet wird, könnte es sich bei Zutreffen dieser Siicht jedoch nicht um eine Symptomatik handeln, die mit Affektstörungen bei Menschen vergleichbar ist, denn die beiden peripher sezernierten Substanzen der Nebennieren haben keine Auswirkungen auf das Zentralnervensystem. Allerdings ist dieser Zusammehang nicht zu beweisen (→ Abschnitt 4.8.7 zur Kausalität der Affektstörungen bei Hypoglykämie).
Die Studie von M. J. Park und ihrem Team wird eingeleitet mit den Worten: „Reports in humans advocate a link between hypoglycemia and altered mood. Such observations, however, have not been mechanistically explored. (...)“, aus denen man Kritik darüber herauslesen kann, dass die Forschung an den Zusammenhängen zwischen einer Hypoglykämie und affektiven Erkrankungen so wenig interessiert ist.
Verschiedene erfahrungsmedizinische Kasuistiken nicht-diabetischer Hypoglykämien findet man in diversen Veröffentlichungen. Es soll hier auf die Bücher des amerikanischen Arztes Harvey M. Ross, einem Pionier auf diesem Gebiet, verwiesen werden. Im deutschsprachigen Raum ist das Buch von Michael Martin lesenswert, aus dem hier schon zitiert wurde (→ Links & Downloads).
Dass ein Diabetes mellitus häufig mit einer Depression einhergeht, weiß man sowohl aus der Erfahrungsmedizin als auch aufgrund von Studien. Eine Meta-Analyse von 20 Einzelstudien aus dem Jahre 2001 ergab folgende Prävalenzen der Diabetikergruppen gegenüber den Kontrollgruppen: Typ‑1‑Diabetiker 21,7% : 8,6%, Typ‑2‑Diabetiker 16,5% : 6,4%, gesamt 20,5% : 11,4%. Unter Diabetikern ist die Depression danach etwa doppelt so häufig verbreitet wie unter Nicht-Diabetikern (Quelle: Ryan J. Anderson, Kenneth E. Freedland et al., The Prevalence of Comorbid Depression in Adults With Diabetes: A meta‑analysis, Diabetes Care, 6/2001, 24 (6), S. 1069 ‑ 1078, http://care.diabetesjournals.org/...).
Zwar kann aus den Ergebnissen derartiger Studien keine eindeutige Kausalbeziehung abgeleitet werden, jedoch liegt die Vermutung nahe, dass ein Diabetes mellitus verschiedene Risikofaktoren in sich birgt und damit die Entstehung einer Depression wahrscheinlicher macht ‑ und ein Risikofaktor ist eben die Hypoglykämie.
Exkurs: Alternative Erklärungen der Zusammenhänge zwischen Affektstörungen und Hypoglykämie
Der US-amerikanische Psychiater Wayne J. Katon veröffentlichte 2013 die Ergebnisse einer Studie, die Zusammenhänge zwischen einer Depression und dem erhöhten Risiko schwerer Hypoglykämien bei Diabetikern feststellte (Quelle: W. J. Katon, B. A. Young et al., Association of Depression With Increased Risk of Severe Hypoglycemic Episodes in Patients With Diabetes, Annals of Family Medicine, 11/3, May/June 2013, Leawood/Kansas, USA, 2013, http://www.ncbi.nlm.nih.gov/...). Katon stellte daraufhin zwei Hypothesen zur Kausalitätsfrage auf, wobei die erste im hier diskutierten Kontext die interessantere ist:
- Die Depression hat neurobiologische Veränderungen zur Folge, die mit starken Schwankungen im Glukosespiegel einhergehen und die Insulintherapie und das Vermeiden von Hypoglykämien erschweren.
- Die Depression belastet Diabetiker so stark, dass sie ihre Insulintherapie nicht mehr vorschriftsgemäß durchzuführen in der Lage sind, und es häufiger zu Entgleisungen des Glukosespiegels kommt.
Zunächst ist anzumerken, dass die Annahme nur zweier Alternativen eines Zusammenhangs zwischen Hypoglykämie und Depression aufgrund viel mannigfaltiger Möglichkeiten völlig unzureichend ist. Beispielsweise sind Diabetiker potentiell ebenfalls von einer nicht-diabetischen Hypoglykämie betroffen, da es auch bei ihnen unabhängig von der Insulingabe zu relativen Glukosemängeln durch einen zu schnell abfallenden Glukosespiegel oder Glukosewertschwankungen kommen kann.
Die zweite Erklärung ist realistisch und steht hier außer Frage, die beschriebene Wechselwirkung nachvollziehbar. Der vermutete Kausalzusammenhang sollte mit einem entsprechenden Studien-Design weiter untersucht werden, beispielsweise durch eine Langzeituntersuchung einer ausreichend großen Anzahl von Diabetikern.
Erklärung 1 ist auf den ersten Blick konträr zu der hier vertretenen Meinung, denn eine (klinische) Depression resultiert kausaltheoretisch gesehen primär aus funktionalen und/oder strukturellen ‑ das heißt neurobiologischen ‑ Veränderungen affektrelevanter Hirnareale, für die sekundär interne Zellschwachstellen und/oder exogene Auslöser verantwortlich sind.
Katons vermuteter Kausalzusammenhang ist von dieser Perspektive aus betrachtet daher schlicht absurd, denn er verdreht Ursache und Wirkung: Er macht einen pathologischen psychiatrischen Zustand, nämlich eine Depression, für neurobiologische Veränderungen verantwortlich. Katon äußert nichts darüber, wie ein derartiges Szenario physiologisch zu begründen ist.
Würde man beispielsweise bei einer Lebererkrankung vergleichbar argumentieren, wäre eine Leberzirrhose verantwortlich für Alkoholismus und nicht umgekehrt der Alkoholismus für die Leberzirrhose.
Katon unterscheidet vor allem nicht zwischen depressiven Verstimmungen und einer Depression - und genau hier liegt die Ursache für die mit seiner ersten Hypothese verbundenen Probleme. Es ist nämlich überhaupt nicht klar, was er sich unter einer Depression genau vorstellt.
Kausaltheoretisch wird strikt zwischen beiden Formen unterschieden: Depressive Verstimmungen sind natürliche und gesunde Reaktionen auf ungünstige Lebensumstände, bei einer Depression handelt es sich dagegen um eine hirnorganische Erkrankung, die in der Regel mit einem Bündel verschiedener Symptome verbunden ist und auch als Affektive Störung bezeichnet wird. Oft scheint eine Depression ohne erkennbare Gründe aufzutreten, denn der oder die für die hirnorganische Dysfunktionalität verantwortlichen Primärauslöser sind auf den ersten Blick entweder nicht zu erkennen oder werden mit der Depression in keinerlei Zusammenhang gebracht.
Bei einer differenzierenden Betrachtung kann man Katons erster Hypothese auch aus kausaltheoretischer Sicht durchaus etwas abgewinnen, dann nämlich, wenn man seine Aussage ausschließlich mit depressiven Verstimmungen in Verbindung bringt. Kausaltheoretisch stellen depressive Verstimmungen nämlich eine zusätzliche Stressbelastung dar, die auf Dauer auch zu Schädigungen an zentralnervösen Glukoseregulierungsorganen und damit einer Hypoglykämie führen könnte.
Ursachen für neurobiologische Schädigungen bei langfristigem Stress sind cortisolbedingte Veränderungen an Hypothalamus und Hypophyse. Diese Vorgänge werden im Teil B des vierten Kapitels noch detaillierter dargestellt und diskutiert (→ Abschnitt 4.12).
Langfristiger Stress stellt zusätzlich eine Gefahr für die Nebenieren dar, denn er kurbelt neben der Cortisolsynthese der Nebennierenrinden auch die Adrenalin- bzw. Noradrenalinsynthese des Nebennierenmarks an, was diese auf Dauer erschöpft und zur Nebenniereninsuffizienz führen kann. Da Nebennieren einen erheblichen Einfluss auf die Glukoseregulation haben, können geschädigte Nebennieren für eine Hypoglykämie mitverantwortlich sein.
4.8.10 Fazit: Nicht-diabetischer Glukosemangel (Hypoglykämie) und Hypoglykämie-Syndrom
Gehirn und Glukose
Nervenzellen können ihre Energieversorgung nur durch einen Abbau von Glukose gewinnen, da sie Fette nicht verstoffwechseln können. Das Gehirn ist somit von einer stetigen Glukoseversorgung über den Blutkreislauf besonders abhängig.
Bei Glukosemangel besteht die Gefahr, dass das Gehirn seine Aufgaben ganz oder teilweise nicht mehr bewältigen kann.
Bedingt durch unvermeidliche Schwankungen der Nahrungszufuhr und des Energiebedarfs muss der Glukosegehalt des Blutes durch körpereigene Regulationssysteme kontrolliert und gesteuert werden. Ziel ist, Körper und Gehirn immer genug Glukose für alle anstehenden Aufgaben zur Verfügung zu stellen.
Damit ist die Energieversorgung des Gehirns wesentlich vom Ernährungsverhalten und der Funktionstüchtigkeit der Blutzuckerregulationssysteme abhängig:
- Zufuhr von Kohlenhydraten mit der Nahrung
Die Qualität der Glukosezufuhr wird von Menge, Struktur und Wertigkeit der Kohlenhydrate in der Nahrung bestimmt.
Bei der Kohlenhydratemenge ist entscheidend, wieviel Glukose eine Mahlzeit enthält bzw. wieviel Glukose über den Tag verteilt konsumiert wird.
Differenzen der molekularen Kohlenhydratestruktur resultieren aus unterschiedlichen Moleküllängen, beispielsweise von Stärke als Polysaccharid (Mehrfachzucker) mit mehr als 500 bis zu mehreren tausend Glukosebausteinen ‑ synonym: komplexe Kohlenhydrate ‑ über Oligosaccharide mit maximal elf Glukosemolekülen, Zweifachzucker (Haushaltszucker) und Einfachzucker (Traubenzucker) mit nur einem Glukosemolekül. Da Zellen nur Einfachzucker verarbeiten, müssen alle Glukoseketten in einem aufwändigen Prozess in einzelne Glukosebausteine zerlegt werden. Das bedeutet: Je länger die Kette ist, desto langsamer erfolgt die Glukoseaufnahme in den Blutkreislauf.
Die Wertigkeit von Kohlenhydraten wird hauptsächlich durch deren industrielle Bearbeitung bestimmt, wobei das hoch verarbeitete raffinierte ballaststofffreie und mikronährstoffarme Weiß- bzw. Auszugsmehl als minderwertiger gegenüber dem relativ gering verarbeiteten ballaststoff‑ und mikronährstoffreichen Vollkornmehl gilt. Zweifach‑ und Einfachzucker werden im Vergleich mit komplexen Kohlenhydraten wegen ihrer schnellen Verfügbarkeit ebenfalls als minderwertiger eingestuft, denn sie können den Blutzuckerspiegel schnell ansteigen lassen und so eine hohe und teilweise sogar überschießende Insulinproduktion mit ungünstigen gesundheitlichen Folgen provozieren.
- Blutzuckerregulationssysteme
Kennzeichnend für die Qualität der Regulationssysteme sind deren Fähigkeiten, den Blutzuckerwert möglichst konstant zwischen 80 und 99 mg/dl (entsprechend 4,4 bis 5,5 mmol/l) zu halten. Unmittelbar nach der Aufnahme von Kohlenhydraten steigt der Wert idealerweise bis zu 140 mg/dl (7,8 mmol/l). An der Blutzuckerregulation wirken zahlreiche Organe mit (→ nachfolgende Aufzählung).
Es gibt zwei Regulationssysteme mit insgesamt sieben Subsystemen. Via Pankreas‑Rückkoppelung wird die Nahrungsglukose reguliert, während die Rückkoppelung via Hypothalamus für die Regulierung des Glukoseangebots bei Stress und Aktivität zuständig ist. Da beide Systeme die gleiche Substanz steuern, sind sie auf funktionaler Ebene miteinander verbunden und sollten aus diesem Grunde nicht isoliert voneinander betrachtet werden.
Ursachen und Charakteristika nicht-diabetischer Hypoglykämie
Aus den oben genannten Gründen resultiert eine nicht‑diabetisch bedingte Glukoseunterversorgung potentiell aus einem ungünstigen Ernährungsverhalten und/oder dysfunktionalen Blutzuckerregulationssystem (Anmerkung: Später wird noch gezeigt, dass die Qualität des Regelsystems noch entscheidender ist als das Ernährungsverhalten).
Diese als nicht‑diabetische Hypoglykämie bezeichnete Erkrankung unterscheidet sich von der diabetischen Hypoglykämie durch ihren fehlenden Bezug zum Diabetes mellitus, denn die diabetische Form beruht ausschließlich auf Unterzuckerungen durch medikamentöse Insulinüberdosierungen bei zuckerkranken Patienten. Dennoch können auch Diabetiker von bestimmten Formen nicht‑diabetischer Hypoglykämie betroffen sein.
Die Anamnese der nicht‑diabetischen Form sollte immer beide Einflussfaktoren ‑ Ernährungsverhalten und Blutzuckerregulationssysteme ‑ berücksichtigen.
Die nicht‑diabetische Hypoglykämie ‑ nachfolgend vereinfachend kurz als Hypoglykämie bezeichnet ‑ hat fünf eindeutige Merkmale:
- Der Blutzuckerwert sinkt unter 80 mg/dl (4,4 mmol/l).
- Der Nüchternglukosewert, der zwischen 80 und 99 mg/dl (4,4 bis 5,5 mmol/l) liegen sollte, wird nach der Nahrungsaufnahme ein- oder mehrfach unterschritten.
- Der Glukosespitzenwert nach einer (durchschnittlichen) Nahrungsaufnahme liegt unterhalb von 130 mg/dl (7,2 mmol/l).
- Schwankungen im Blutzuckerkurvenverlauf statt stetigem Steigen und Abfallen der Kurve.
- Zu schneller Blutzuckerabfall nach Erreichen des Spitzenwerts.
Zu unterscheiden sind absolute und relative Hypoglykämie. Während absolute Hypoglykämie immer einen Zustand charakterisiert, bei dem der Nüchtern-Glukosespiegel weniger als 80 mg/dl (4,4 mmol/l) bzw. der Spitzenwert weniger als 130 mg/dl (7,2 mmol/l) beträgt (Nr. 1, 2 und 3), bezeichnet die relative Hypoglykämie ungünstige Glukosespiegelveränderungen unabhängig von der jeweiligen Höhe des Blutzuckerspiegels (Nr. 4 und 5). Daher können auch Diabetiker von der relativen Hypoglykämie betroffen sein.
Risikofaktor Ernährung
Unter dem Verdacht, für eine Hypoglykämie mitverantwortlich zu sein, stehen die nachfolgend aufgezählten ungünstigen Ernährungsweisen. Sowohl Überfluss als auch Mangel an Kohlenhydraten und/oder eine Unterversorgung mit Mikronährstoffen können die Blutzuckerregulationssysteme überlasten und zur Hypoglykämie führen, beispielsweise Nr. 1 bis 3 der nachfolgenden Aufzählung, die aufgrund des übermäßigen Kohlenhydrateangebots potentiell eine zu hohe Insulinproduktion provozieren:
- Zu viele Kohlenhydrate auf einmal, aber auch zu viele über den Tag verteilt.
- Zu viele Zwei- oder Einfachzucker, zu wenig komplexe Kohlenhydrate.
- Zu viel Weiß- bzw. Auszugsmehl ohne Mikronährstoffe.
- Ernährungsbedingter Mangel an Mikronährstoffen, vor allem solchen, die wesentlich an der Blutzuckerregulation beteiligt sind, in erster Linie Chrom, Magnesium, Zink und Vitamin B3 (Niacin).
- Kurz-, mittel- oder langfristig zu wenig oder keine Kohlenhydrate, zum Beispiel bei Fastenkuren oder Nahrungsmittelknappheit.
Grundsätzlich sollten Blutzuckerregulationssysteme jedoch in der Lage sein, bei kurz- bis mittelfristig ungünstigem Ernährungsverhalten hypoglykämische Zustände zu vermeiden, zumindest wenn das Ernährungsfehlverhalten in einem üblichen Rahmen bleibt. Arbeiten die Systeme jedoch nicht korrekt, ist die Wahrscheinlichkeit einer hypoglykämischen Entgleisung hoch, zum Beispiel durch die schon erwähnte „überschießende“ Insulinausschüttung.
Bei langfristigem Ernährungsfehlverhalten ist auch eine organische Schädigung des Regulationssystems durch ständige Überforderung nicht auszuschließen, und die Gefahr hypoglykämischer Reaktionen steigt, ebenfalls die Gefahr einer Chronifizierung der Hypoglykämie.
Risikofaktor Blutzuckerregulationsstörungen
Ein ungünstiges Ernährungsverhalten ist daher ‑ zumindest kurz‑ bis mittelfristig ‑ weder eine ausreichende noch eine notwendige Bedingung für einen hypoglykämischen Blutzuckerverlauf, da ein funktionierendes Regulationssystem dem Fehlverhalten entgegenwirkt und den Blutzuckerverlauf dennoch korrekt steuert.
Viel entscheidender für die Glukoseversorgung ist daher die Funktionstüchtigkeit bzw. Funktionsuntüchigkeit der Blutzuckerregulation, die von der Tätigkeit folgender Organe bzw. Organsysteme abhängt:
- Hypothalamus-Hypophysen-Achse
- Schilddrüse
- Leber
- A- und B-Langerhanszellen des Pankreas
- Nierenrinde
- Nebennierenrinde
- Nebennierenmark
Weitere für die Blutzuckerregulation relevanten Organe sind:
- Dünndarm
- Peripheres Nervensystem mit Rückenmark
- Gestreifte (Skelett-)Muskulatur
Diese Organe sorgen gemeinsam dafür, dass trotz Schwankungen der Nahrungsaufnahme und des Glukosebedarfs die Blutzuckerwerte immer ausreichend hoch sind, idealerweise zwischen 80 und 99 mg/dl (4.4 und 5,5 mmol/l) und sich die Blutzuckerwerte moderat ändern, das heißt keine Schwankungen und kein zu schnelles Sinken des Blutzuckers nach Erreichen eines optimalen Spitzenwertes zwischen 130 und 140 mg/dl (7,2 bis 7,8 mmol/l).
Für Hypoglykämie ist daher vor allem ein dysfunktionales Blutzuckerregulationssystem als Primärverursacher verantwortlich, Ernährung ist an zweiter Stelle von Bedeutung und von sekundärer Bedeutung. Das ändert aber nichts an der Notwendigkeit, beide Einflussfaktoren bei Anamnese und Diagnose zu berücksichtigen (→ Unterabschnitt Anamnese und Diagnose der Hypoglykämie).
Die Komplexität eines durch viele Organe beeinflusstes Regulationssystem kann einerseits dessen Anfälligkeit erhöhen, andererseits können funktionstüchtige Teile funktionsgestörte Teile bis zu einem bestimmten Grad kompensieren, so dass Blutzuckerwerte trotz Problemen einzelner Regelungsorgane dennoch unauffällig bleiben.
Diagnose Hypoglykämie
Die (nicht-diabetische) Hypoglykämie wird in der Medizin weitgehend ignoriert, obwohl der englische Arzt Seale Harris über sie erstmals im Jahre 1924 in einem Fachbeitrag berichtete. Die Folgen dieser Ignoranz sind erhebliche Unkenntnisse über die Konsequenzen von Hypoglykämie und Mängel in der Diagnostik.
Hypoglykämie bleibt daher auch noch heute in vielen Fällen unerkannt, was für die Betroffenen mit entsprechend negativen Konsequenzen verbunden ist. Der Internist Friedrich Meythaler schätzte im Jahre 1966 den Anteil der Bevölkerung mit Hypoglykämie auf 15 Prozent.
Anamnese und Diagnose einer Hypoglykämie wird darüber hinaus durch die Notwendigkeit erschwert, ein komplexes Regulationssystem und individuelles Ernährungsverhalten berücksichtigen zu müssen.
Allerdings erleichtern einige „Faustregeln“ diese Aufgabe:
- Ein hypoglykämischer Blutzuckerverlauf deutet unabhängig von der Ernährungsweise auf ein fehlerhaft arbeitendes Blutzuckerregulationssystem als Primärursache hin, denn es sollte auch bei einer suboptimalen Ernährungsweise ‑ beispielsweise dem häufigeren Konsum zuckerhaltiger Speisen ‑ optimal funktionieren, zumindest solange das Fehlverhalten in einem üblichen Rahmen bleibt.
- Daher schützt auch eine in puncto Kohlenhydrateversorgung vorbildliche Ernährungsweise ‑ beispielsweise durch den Verzicht auf zuckerhaltige Speisen und eine ausreichende Versorgung mit Mikronährstoffen ‑ wegen eines potentiell dysfunktionalen Regulationssystems nicht vor Hypoglykämie.
Schlussfolgerungen: Das Ernährungsverhalten hat Einfluss auf die Blutzuckerregulation, kann aber lediglich sekundär für eine Hypoglykämie mitverantwortlich sein. Um die Ursachen einer Hypoglykämie einzugrenzen zu können, sind sämtliche regelkreisinvolvierten Organe auf Schwachstellen zu untersuchen.
Hypoglykämie, Affektstörungen und Hypoglykämie-Syndrom
Da Patienten in der Regel nicht mit einem „Verdacht auf Hypoglykämie‑Syndrom“, sondern wegen psychiatrischer oder anderer Symptome unbekannter Ursache in eine Praxis kommen, besteht eine weitere Herausforderung darin, Affektstörungen mit Hypoglykämie in Verbindung zu bringen.
Eine Hypoglykämie kann psychiatrische Störungen auslösen oder schon bestehende psychiatrische Störungen verstärken, da affektrelevante Hirnareale empfindlich auf eine unzureichende und/oder schwankende Glukoseversorgung reagieren.
Dabei wird die Tatsache unterschiedlicher Reaktionsmuster und -intensitäten bei Hypoglykämie auch mit Hilfe der kausaltheoretischen Modelle verständlich, denn die Art und Weise der Reaktion auf Glukosemängel hängt wesentlich vom Zustand dieser Gehirnareale ab (→ Kapitel 1, Abschnitte 1.3 ff.).
Tritt eine Hypoglykämie mit verschiedenen ‑ insbesondere psychiatrischen ‑ Symptomen unbekannter Ursachen auf, ist daher vom Verdacht auf Hypoglykämie‑Syndrom auszugehen. Der Begriff „Hypoglykämie‑Syndrom“ schließt sämtliche affektiven und nicht‑affektiven Symptome mit ein, für die eine (nicht‑diabetische) Hypoglykämie (mit‑)verantworlich ist.
Affektstörungen, die im Zusammenhang mit Hypoglykämie häufig vorkommen:
- Übellaunigkeit/Gereiztheit
- Aggressivität
- Ruhelosigkeit oder Überaktivität
- Hypomanie oder Manie
- Angstzustände
- Phobien
- Stimmungsschwankungen
- Stimmungstiefs
Bei einem Zusammentreffen von Hypoglykämie und Affektiven Störungen gibt es verschiedene Möglichkeiten eines Zusammenhangs. Die folgende Aussagen treffen aber immer zu:
- Resultieren aus einer Hypoglykämie Affektive Störungen oder werden bestehende Affektstörungen verstärkt, beruht das auf Problemen affektrelevanter Hirnareale mit dem absoluten oder relativen Glukosemangel (→ Kapitel 1, Abschnitt 1.5). Hierbei handelt es sich um einen direkten Kausalzusammenhang.
- Neben einer Kausalbeziehung können Hypoglykämie und Affektstörungen auch korrelativ miteinander in Verbindung stehen. Bestimmte erkrankte regelkreisrelevante Organe, insbesondere das Hypothalamus-Hypophysen-System, verantworten in diesem Falle sowohl Hypoglykämie als auch Affektstörungen direkt, so dass es keinem zusätzlichen Glukoseengpass für die Entstehung affektiver Probleme bedarf. Allerdings besteht die Möglichkeit, dass sich Affektive Störungen bei Glukoseengpässen verstärken; diesem Fall läge ein gemischter korrelativ-kausaler Zusammenhang vor.
- Ebenfalls sind Hypoglykämie und Affektstörungen auch rein zufällig parallel ohne Zusammenhang denkbar (koinzident).
- Depressive Verstimmungen, ein klar von der Depression abzugrenzendes Krankheitsbild, können bei Hypoglykämie sowohl ausschließlich als auch zusätzlich auftreten. Sie sind Reaktionen auf den als belastend empfundenen Zustand bei Hypoglykämie, beispielsweise durch damit verbundene körperliche (nicht-affektive) Symptome.
Mit einer Hypoglykämie einhergehende nicht-affektive Symptome sowohl psychiatrischen als auch nicht-psychiatrischen Charakters, beispielsweise Psychosen, Unruhezustände, Zittern, Heißhungerattacken oder Verwirrung, haben vergeichbare Erklärungsmuster wie affektive Symptome. Einige von ihnen werden zentralnervös, andere durch periphere Prozesse, beispielsweise von Schilddrüse, Pankreas oder Nebennieren und einer Hormonausschüttung mitausgelöst.
Relevanz der Hypoglykämie als Mitverusacherin affektiver Erkrankungen
Die allgemeine Relevanz von Kohlenhydraten bzw. Glukose für den Zellstoffwechsel liegt mit einer Bewertung von zwei Punkten (→ Abschnitt 3.4.2) im Mittelfeld und gleichauf mit Sauerstoff und der ursprünglichen Erbinformation.
Im besonderen Zusammenhang mit Affektiven Störungen ist die Bedeutung nach den hier gewonnenen Erkenntnissen eher noch gestiegen. Dies liegt vor allem an folgenden Umständen:
- Kohlenhydrate/Glukose sind als einziger Energieträger im zentralen Nervensystem unverzichtbar. Alle anderen Zellen können auch Fette zur Energieversorgung nutzen.
- Die Glukoseverfügbarkeit ist hauptsächlich von endogenen Regelkreisen abhängig und entzieht sich somit zu einem großen Teil einer bewussten Steuerung von außen. Sie ist damit auch von der Funktionsfähigkeit dieser autonomen Systeme abhängig.
- Die Existenz eines kausalen Zusammenhangs zwischen Hypoglykämie und Affektstörungen ist seit etwa 100 Jahren ein sowohl in Erfahrungs- als auch evidenzbasierter Medizin weit verbreiteter Fakt.
4.9 Sauerstoffmangel und Affektstörungen ▲
Sauerstoff ist ‑ zusammen mit Glukose (→ Abschnitt 4.8) ‑ eine weitere wichtige Voraussetzung für die Energieversorgung einer Zelle. Mit Hilfe des Sauerstoffs wird organische Glukose zu anorganischen Stoffen abgebaut. Dabei wird Energie freigesetzt.
Im Gegensatz zu Glukose kann der Körper Sauerstoff nicht speichern. So mobilisiert eine länger unterbrochene Nahrungsaufnahme Glukosereserven der Muskel- und Leberzellen oder die Synthese von Glukose aus anderen Substanzen (→ Abschnitt 4.8). Wird dagegen die Sauerstoffversorgung komplett unterbrochen, hat das sofort üble Konsequenzen ‑ insbesondere für Nervenzellen ‑ und führt schon nach ca. zehn bis zwölf Sekunden zur Bewusstlosigkeit. Innerhalb von 60 Sekunden ist der Sauerstoff in den Nervenzellen verbraucht und die zelluläre Atmungskette kommt zum Erliegen. Nach einigen Minuten ist das ATP in den Zellen vollständig verbraucht. Abhängig von der Körpertemparatur sterben nach drei bis sechs Minuten erste Hirnzellen ab, und nach der neunten Minute treten in der Regel größere Hirnschäden auf, die als hypoxische Nekrosen bezeichnet werden.
In Relation zum Gesamtverbrauch des Körpers benötigt das Gehirn bei durchschnittlich nur 1.300 Gramm Gewicht ca. 20% des gesamten Sauerstoffs. Dabei ist der Verbrauch der Nervenzellen zehnmal höher als der Verbrauch der Gliazellen. Auch das zeigt, wie wichtig Sauerstoff für das Nervensystem ist.
Reaktive Sauerstoff-Spezies (ROS) und Sonderfälle von Sauerstoffvergiftungen
Im gesamten Abschitt 4.9 geht es ausschließlich um Sauerstoff als lebenserhaltenden Kausalfaktor und die Ursachen und Folgen eines Mangels für Gehirn und Affekterkrankungen.
Die Verstoffwechslung des Sauerstoffs hat aber auch die Produktion aggressiver Substanzen zur Folge, die zellschädigende Eigenschaften haben und als reaktive Sauerstoff-Spezies (ROS, für den englischen Fachterminus Reaktiv Oxygen Spezies) bezeichnet werden.
Ursachen und Folgen dieser problematischen Sauerstoffeigenschaften werden als eigenständiges Thema im Teil B des vierten Kapitels erörtert (→ Abschnitt 4.13) und spielen in Abschnitt 4.9 keine Rolle.
Wie die optimale Menge Sauerstoff zu den Nerven- und Gliazellen des Gehirns gelangt
Idealerweise enthält Atemluft 21% Sauerstoff, der über die Haut und Lungenatmung in den Körper gelangt, wobei die Hautatmung vernachlässigbar ist, da sie nur einen Anteil von einem Hundertstel an der gesamten Atmung hat und ausschließlich die oberen Hautschichten betrifft.
Durch das Einatmen wird molekularer Sauerstoff O2 in die Lungenbläschen (Alveolen) transportiert und über Kapillargefäße in den Blutkreislauf abgegeben.
Größtenteils bindet Sauerstoff an den roten Blutfarbstoff Hämoglobin, der sich in den roten Blutkörperchen (Erythrozyten) befindet. Der Anteil des mit Sauerstoff gesättigten Hämoglobins ist die Sauerstoffsättigung (sO2). Normalerweise hat das arterielle Blut zwischen 90 und 96% sO2. Daneben kann das Blutserum eine geringe Menge an Sauerstoff auch ohne Hilfe des Hämoglobins aufnehmen, was als Sauerstoff‑Partialdruck (pO2) bezeichnet wird. Normalerweise beträgt der Partialdruck des arteriellen Blutes zwischen 65 und 100 mmHg. Eine niedrige Sauerstoffsättigung geht mit einem niedrigen Sauerstoff‑Partialdruck einher und umgekehrt.
Damit befördern hauptsächlich Erythrozyten den Sauerstoff über das arterielle Blutgefäßsystem in die Hirnkapillargefäße. Dort findet der im Vergleich mit den Vorgängen in den Lungenbläschen umgekehrte Vorgang statt: Der Sauerstoff der Erythrozyten und der freie Blutsauerstoff werden in das Hirngewebe abgegeben.
Eine optimale Sauerstoffversorgung des Zentralnervensystems ist wesentlich das Ergebnis einer optimalen lokalen Durchblutungssituation. Um diese zu gewährleisten, muss das Gehirn mit drei sich ständig ändernden Einflüssen zurechtkommen:
- Blutdruck,
- Kohlendioxid- und Sauerstoffgehalt des Blutes und
- unterschiedlichen Sauerstoffbedarfen einzelner Hirnregionen.
Zu 1.: Eine grundlegende Regulation des zerebralen Blutfusses ist aufgrund des sich ständig verändernden systolischen Blutdrucks notwendig. Regulationsziel ist es, Blutfluss bzw. Blutdruck im Gehirn dennoch annähernd konstant zu halten. Die Regulation erfolgt hauptsächlich autonom über Stoffwechselreaktionen an Ort und Stelle, bei denen die Hirngefäße ihre Durchmesser verengen oder erweitern. Dies geschieht über eine Kontraktion der Gefäßmuskulatur. Bei einer Blutdruckerhöhung verengen sich die Hirnarterien und -arteriolen, bei einem Blutdruckabfall erweitern sie sich (Bayliss-Effekt). Damit das gut funktioniert, müssen die Blutdruckwerte jedoch in einem gewissen Rahmen bleiben, der zwischen Werten von 50 und 150/170 mmHg liegt. Daneben gibt es noch einen zentralnervösen Einfluss über den Sympatikus auf die Gefäßmuskulatur, der aber nur eine geringe Rolle spielt.
Zu 2.: Die Menge des neben dem Sauerstoff zweitwichtigsten Blutgases Kohlendioxid (CO2) beeinflusst wesentlich die Hirndurchblutung und damit die Sauerstoffversorgung, denn physiologisch ist der Kohlendioxidgehalt und nicht der Sauerstoffgehalt des Blutes für den Regelungsprozess entscheidend. Zwar reagieren die Gefäße auch auf einen Abfall des Sauerstoffs, jedoch ist diese physiologische Reaktion eher vernachlässigbar. So steigt bei einer ungenügenden Atmung (Hypoventilation) der CO2‑Partialdruck des Blutes, während der O2‑Partialdruck sinkt. Der ansteigende CO2‑Partialdruck bewirkt dann die Erweiterung arterieller Hirngefäße. Im umgekehrten Fall der Hyperventilation bleibt der O2‑Partialdruck annährend konstant, während der CO2‑Partialdruck sinkt und u. a. zu einer Verengung peripherer arterieller Blutgefäße führt. Das hat im Gehirn eine Unterversorgung mit Sauerstoff zur Folge, was auf den ersten Blick paradox wirkt. Da die Hyperventilation meist eine kurzfristige Reaktion auf starken psychischen Stress darstellt, kommt es nicht zu langfristigen Schäden.
Zu 3.: Aktive Hirnregionen benötigen mehr Sauerstoff als weniger aktive, so dass die Durchblutung dort steigen muss und es im Idealfall auch tut. Die Mechanismen dieser komplexen Vorgänge sind größtenteils noch unbekannt.
4.9.1 Sauerstoffunterversorgung des Gehirns: Ursachen und Auswirkungen
Eine als zerebrale Hypoxie bezeichnete Sauerstoffunterversorgung liegt vor, wenn das Sauerstoffangebot im Gehirn niedriger ist als dessen Sauerstoffbedarf. In der Regel wird bei zerebraler Hypoxie zu wenig Sauerstoff über den Blutkreislauf zugeführt. Eine zerebrale Hypoxie besteht aber auch dann, wenn Hirnzellen einen besonders hohen Sauerstoffbedarf haben, beispielsweise bei Fieber oder Stress, und vom durchschnittlichen Sauerstoffangebot über den Blutkreislauf nicht ausreichend versorgt werden.
Hypoxien sind endogen im Körper oder exogen begründet, es werden fünf Hypoxieursachen unterschieden:
- Ischämie (Ischämische Hypoxie)
Hier kommt es zu einer kompletten oder teilweisen Blutzufuhrunterbrechung, auch als absolute oder relative Ischämie bezeichnet.
Auslöser einer zerebralen ischämischen Hypoxie sind Engstellen oder Verschlüsse von Hirnarterien und größeren Arteriolen, eine pathologisch veränderte Mikrozirkulation des Blutes in den kleinen Arteriolen, Kapillargefäßen und Venolen des Gehirns oder Herzerkrankungen. Eine ungenügende Herzpumpleistung bedeutet meist eine relative Ischämie. Ein Herz-Kreislauf-Stillstand, beispielsweise nach einem Herzinfarkt, hat immer eine absolute Ischämie zur Folge. Auch ein vor, während oder nach der Geburt eintretender Sauerstoffmangel des Gehirns Neugeborener wird als zerebrale ischämische Hypoxie bezeichnet.
- Anämie (Anämische Hypoxie)
Hierbei handelt es sich entweder um eine Blutmangelerkrankung, bei der zu wenig Erythrozyten bzw. Hämoglobin für die Beladung mit Sauerstoff zur Verfügung steht oder eine extern verursachte Sauerstoffbindungsbeeinträchtigung des Hämglobins. Letzeres geschieht sehr massiv durch eine Kohlenmonoxidvergiftung (Kohlenmonoxid verdrängt Sauerstoff) oder auch in einer wesentlich geringeren Weise durch Substanzen, die zu einer Oxidation des Hämoglobins führen (zum Beispiel eine hohe Nitratkonzentration in Nahrung oder Trinkwasser oder das Einatmen von Nitriten).
- Hypoxämie (Hypoxämische Hypoxie)
Bei einer geringen Blutsauerstoffsättigung stehen zwar genügend Erytrozyten zur Verfügung, jedoch werden sie nur unzureichend mit Sauerstoff angereichert.
Dafür gibt es zwei Hauptgründe: Erkrankungen des Atmungssystems mit der Folge respiratorischer Insuffizienz, insbesondere beim Lungenemphysem und bei chronischer Bronchitis bzw. COPD, bei Asthma, Flachatmung/Dyspnoë, Schlafapnoë, Schnarchen/Rhonchopathie und/oder eine zu geringe Sauerstoffzufuhr aus anderen Gründen, beispielsweise bei einem Aufenthalt in großer Höhe, bei hoher Luftverschmutzung bzw. Smog, hohen Ozonwerten, bei Fehlern in der Sauerstoffversorgung während medizinischer Operationen (Hypoxydose), bei ständigem Schlafen mit geschlossenen Fenstern oder bei Sportarten bzw. beruflichen Tätigkeiten, die mit Unterbrechungen der Sauersstoffzufuhr einhergehen (zum Beispiel Apnoë-Tauchen) und im Falle des Ertrinkens.
- Zytotoxische Hypoxie (synonym: Histotoxische Hypoxie)
Zu Sauerstoffverwertungsstörungen in den Hirnzellen kommt es durch die Aufnahme toxischer Substanzen, sogenannter Zytotoxine (Zellgifte). Beispiele sind Zyankali (Blausäure), Pentachlorphenol (PCP), Alkohol oder Schlafmittel.
- Nachfragebedingte Hypoxie
Der erhöhte Sauerstoffbedarf, beispielsweise bei hohem Fieber oder Stress, kann durch das durchschnittliche Sauerstoffangebot nicht befriedigt werden.
4.9.2 Zerebrale Hypoxie und Affektstörungen
Die individuellen Auswirkungen einer Sauerstoffunterversorgung des Gehirns ‑ sowohl quantitativer als auch qualitativer Art ‑ hängen von mehreren Faktoren ab:
- Ursachen der zerebralen Hypoxie, insbesondere bei der Frage, ob eine absolute oder relative zerebrale Ischämie vorliegt (→ Nr. 1. bis 5. oben)
- Dauer der zerebralen Hypoxie - je länger die Hypoxie dauert, desto massiver die Schädigung
- Lokalisation der zerebralen Hypoxie - verschieden betroffene Hirnareale führen zu unterschiedlichen Symptomen
Schädigt ein kurz-, mittel- oder langfristiger Sauerstoffmangel die für Affekte und Antrieb zuständigen Hirnareale (→ Kapitel 1, Abschnitt 1.5), besteht die hohe Wahrscheinlichkeit für den Ausbruch oder die Verstärkung einer Affekterkrankung.
Da einige dieser Hirnareale auch für die Steuerung verschiedener Körperfunktionen sowie für das Gedächtnis zuständig sind, ist ebenfalls eine Störung weiterer Hirnleistungen möglich.
Problematisch: Unerkannte oder unterschätzte Erkrankungen
Erkrankungen der Atmung und des Herz-Kreislauf-Systems einschließlich der Gefäße gehen naturgemäß häufig mit einer Sauerstoffunterversorgung einher. Sind diese bei von Affektstörungen Betroffenen sicher diagnostiziert, sollten Zusammenhänge zwischen beiden Erkrankungen in Beracht gezogen werden. Es besteht die Chance, die Ursachen der Affekterkrankung weiter einzugrenzen und die Diagnose zu vertiefen.
Wesentlich problematischer sind jedoch Erkrankungen oder Lebensumstände, die nicht wahrgenommen werden oder bei denen ein hirnschädigender Sauerstoffmangel nicht erwogen wird und die dennoch an der Genese der affektiven Erkrankung beteiligt sein könnten.
Hierunter fallen vor allem sich schleichend entwickelte chronisch verlaufende Erkrankungen oder besondere Lebensumstände, die zu einer verminderten Sauerstoffaufnahme bzw. Sauerstoffversorgung führen:
- Generelle Hirnurchblutungsstörungen
Arteriosklerose der vier großen Arterien, die das Gehirn mit Blut versorgen, unter anderem der beiden Carotis-Arterien, können zu einer generellen Minderdurchblutung führen und vor allem durch den damit verbundenen Sauerstoffmangel Hirnschäden verursachen.
Oft machen sich derartige arteriosklerotische Veränderungen durch transitorisch‑ischämische Attacken (TIA) bemerkbar. Anzeichen dafür sind zum Beispiel wiederkehrende neurologische Auffälligkeiten, insbesondere Schwindel im Zusammenhang mit Gehstörungen, Zittern, Verwirrtheit, aber auch psychiatrische Symptome, beispielsweise Halluzinationen. Transitorisch‑ischämische Attacken deuten auf massive Probleme der Hirndurchblutung und Sauerstoffmangel hin. Darüber hinaus sind sie Vorboten eines drohenden Apoplex.
TIA werden vor allem in der Anfangsphase häufig nicht wahrgenommen oder fehlgedeutet. Auch plötzliche Veränderungen der Stimmungslage werden meist nicht als ein mögliches TIA‑Symptom ernst genommen.
Aber auch ohne transitorisch‑ischämische Attacken können generelle Durchblutungsstörungen vorliegen, die das Gehirn negativ beeinflussen und Affektstörungen oder andere psychiatrisch-neurologische Erkrankungen triggern. Gerade solche Situationen sind besonders heimtückisch, da dadurch eine wesentliche Erkrankungsursache der Affektstörungen oft unerkannt bleibt.
- Lokale Durchblutungsstörungen in affektrelevanten Hirnarealen
Ursachen sind lokale Verletzungen oder degenerative Veränderungen der Arteriolen oder Kapillargefäße, die die Mikrozirkulation des Blutes behindern und einen lokalen Sauersstoffmangel und weitere Versorgungsstörungen verursachen. Auf diesen ungünstigen Veränderungen basiert unter anderem auch die vaskuläre Demenz.
Derartige Hirngefäßveränderugen können in affektrelevanten Hirnregionen zu einer vasuklär verursachten Affektstörung führen, die ‑ je nach Ursache ‑ auch jüngere Menschen betreffen kann.
Leider sind solche Veränderungen mit den heutigen bildgebenden Verfahren oft nicht nachweisbar, vor allem, wenn sie nur sehr kleine Hirnregionen betreffen.
- Ein länger zurückliegender Apoplex
Sind nach einem überstandenen Apoplex zunächst keine Veränderungen an Stimmung und/oder Antrieb wahrnehmbar, können die entstandenen Gefäßverschlüsse dennoch Jahre später auftretende Affektstörungen mitverursachen.
Der Grund liegt darin, dass weitere Stressfaktoren, die im Laufe der Zeit dazukommen, den vorgeschädigten Hirnarealen weiter zusetzen. Da ein (weißer) Schlaganfall auf krankhafte Gefäßveränderungen im Gehirn hinweist, ist es nicht verwunderlich, wenn es auch danach zu weiteren bzw. chronischen Hirndurchblutungsstörungen kommt.
Der zurückliegende Apoplex und die später abhängig oder unabhängig davon auftretenden Noxen sind dann gemeinsam für die Affektstörungen verantwortlich. Vor allem aufgrund des zeitlichen Abstands besteht die Gefahr, die Rolle des früheren Apoplex bei der Genese der Affektstörung zu übersehen.
- Schlafapnoë
Beim Schlafapnoë-Syndrom ‑ oder kurz Schlafapnoë ‑ handelt es sich um eine gefährliche Störung des Atmungssystems, bei der es während der Nacht zu Atemaussetzern bzw. Atempausen kommt, die in ihrer Länge und ihren Zeitabständen individuell sehr unterschiedlich sind. Eine Schlafapnoë geht häufig mit Schnarchen (Rhonchopathie) einher.
Die unmittelbaren Ursachen liegen im Verschluss oberer Atemwege aufgrund einer Rachenmuskelerschlaffung (obstruktive Schlafapnoë) und/oder einer Störung des Atemzentrums in der Medulla oblongata des Gehirns, bei der trotz freier Atemwege die atemrelevante Muskulatur nicht aktiviert wird (zentralnervös verursachte Schlafapnoë).
Die unmittelbaren Folgen sind eine Sauerstoffunterversorgung im Schlaf mit einer Sauerstoffsättigung von zum Teil unter 80% (die Normwerte liegen zwischen 90 und 96%) und unbemerkte Weckreaktionen als Notfallstrategie des Körpers, damit der Betroffene nicht erstickt.
Letztere stören den Schlafrhythmus erheblich, so dass der Schlaf seine erholende Funktion nicht mehr erfüllt, was einen erheblichen zusätzlichen Stressfaktor darstellt.
Das Schlafen bei geschlossenen Fenstern mit sauerstoffarmer bzw. verbrauchter Luft und Schnarchen verschärfen den Sauerstoffmangel zusätzlich.
Anzeichen einer Schlafapnoë sind Tagesmüdigkeit, zum Teil mit Sekundenschlaf, Reizbarkeit und Konzentrationsstörungen. Auch Albträume können auf eine Schlafapnoë hindeuten.
Langfristig wirkt sich eine unbehandelte Schlafapnoë allem wegen des Sauerstoffmangels fatal auf den gesamten Körper und insbesondere auf das Gehirn aus.
- Rhonchopathie bzw. obstruktives Schnarchen
Oft geht die oben beschriebene Schlafapnoë mit obstruktivem Schnarchen einher. Daher weist Schnarchen auch auf eine eventuell bestehende Schlafapnoë hin.
Aber auch für sich genommen stellt obstruktivves Schnarchen einen Risikofaktor dar.
Beide Erkrankungen ähneln sich bezüglich der Ursachen und Folgen. Von obstruktivem Schnarchen spricht man, wenn es es, wie bei der Schlafapnoë, zu einer reduzierten Sauerstoffaufnahme während des Schlafs kommt, der auch von Störungen des Schlafrhythmus begleitet werden kann, dieses jedoch von einem erschlafften Gaumensegel oder einer in den Rachenraum zurückfallenden Zunge verursacht wird, womit auch die störenden Geräusche verbunden sind. Beim Schnarchen wird der Atemfluss somit nicht unterbrochen. Die unmittelbaren Folgen sind daher weniger ausgeprägt als bei der Schlafapnoë.
HNO-Fachleute beziffern den Abfall der Blutsauerstoffsättigung bei obstruktiver Rhonchopathie mit ca. 5% oder leicht darüber. Dementsprechend ist dann auch von milderen langfristigen Folgen auszugehen.
Auch für die Rhonchopathie gilt: Das Schlafen bei geschlossenen Fenstern verschärft die Sauerstoffunterversorgung zusätzlich.
- Häufige oder längere Aufenthalte in großen Höhen ohne Sauerstoffgerät oder Apnoë-Tauchen
Alle Sportarten oder Lebensumstände, die die Sauerstoffzufuhr negativ beeinflussen, führen durch die damit verbundene niedrigere Blutsauerstoffsättigung zu Belastungen sämtlicher Organe, insbesondere einer Belastung des Zentralnervensystems.
- Langjährige bzw. häufige Inhalation von Nitriten (sog. „Schnüffelstoffe“)
Die in verschiedenen Partykreisen als Rauschmittel verwendeten Substanzen Amylnitrit, Isopropylnitrit, Cyclohexylnitrit oder Isobutylnitrit, auch unter dem Namen „Poppers“ bekannt, führen über die Umwandlung des Hämoglobins in Methämoglobin zu einer hypoxischen Anämie und setzen die Sauerstoffsättigung des Blutes herab. Bei einer zu häufigen und zu intensiven Anwendung und dem damit verbundenen Sauerstoffmangel besteht die Gefahr, dass es zu Schädigungen des Zentralnervensystems kommt.
4.9.3 Empirische Forschung: Auswirkungen des Sauerstoffmangels auf Nervensystem und Affekte
Vergleichbar mit dem Desinteresse an der Erforschung nicht-diabetischer Hypogykämien ist das Desinteresse an der Erforschung von Zusammenhängen zwischen kurz-, mittel- oder langfristigen Sauerstoffunterversorgungen und Affektstörungen. Auch Forschungen über generelle Auswirkungen eines Sauerstoffmangels auf das Nervensystem gibt es kaum.
Studien, die sich mit Affektstörungen bei Erkrankungen des Atemsystems beschäftigen, werden überwiegend im angelsächsischen Sprachraum durchgeführt. Schwerpunkte der Untersuchungen sind die chronisch obstruktiven Lungenerkrankungen (COPD), zu denen hauptsächlich die chronische Bronchitis und das Lungenemphysem zählen, und das Schlafapnoë-Syndrom.
Sauerstoffmangel bei COPD und die allgemeinen Folgen für das zentrale Nervensystem
Im Zusammenhang mit COPD und Schädigungen des Zentralnervensystems durch eine ständig zu geringe Sauerstoffzufuhr legten im Jahre 2012 Haiyan Zhang und ihr Team interessante Studienergebnisse vor, denn sie wiesen vor allem in affektrelevanten Hirnarealen Schäden nach (Quelle: Haiyan Zhang et al., Grey and white matter abnormalities in chronic obstructive pulmonary disease: a case–control study, Department of Physiology, Medical College of Xiamen University, Xiamen, China und Department of Brain Protection and Plasticity, Institute of Basic Medical Sciences, Beijing, China, BMJ Open, 03/2012, http://www.researchgate.net/publication/2...).
Für diese Studie wurden 50 Probanden rekrutiert, die mit ihren Körpermerkmalen und Lebensweisen, einschließlich des Nikotinkonsums, vergleichbar waren, wobei 25 von ihnen an COPD in einem ähnlichen Stadium erkrankt waren. Bei den an COPD Erkrankten wurden Schädigungen in fast allen Hirnregionen, verbunden mit einer geringeren Dichten an grauer Hirnstubstanz, festgestellt.
Betroffen waren vorderer und unterer Cortex, einige der unteren Großhirnkerne und das Zwischennhirn, wobei auffällig viele affektrelevante Areale (→ Kapitel 1, Abschnitt 1.5) betroffen waren:
- verschiedene Bereiche der Gyrus cinguli der unteren Großhirnrinde,
- Thalamus (beidseitig),
- Stammganglien (hier: Nucleus caudatus),
- Amygdala und der
- Fornix.
Ebenfalls wurden Schäden in Teilen des Gyrus parahippocampalis gemessen, jedoch ist eine Zuordnung dieses Areals zum emotionalen System nicht eindeutig zu treffen (→ Kapitel 1, Abschnitt 1.5).
Auch wies die Inselregion (Insula) des seitlichen Cortex geringere Dichten an grauer Substanz auf. Einige Forschungen deuten darauf hin, dass auch diese Region an der Entstehung oder Verarbeitung von Affekten beteiligt ist.
Die Schäden an der grauen Substanz korrelierten darüber hinaus mit messbaren Aspekten der Erkrankungsintensität. Eine negative Korrelation ergab sich zwischen Dichteverlust der grauen Hirnsubstanz und Sauerstoffpartialdruck pO2, eine positive Korrelation zwischen Dichteverlust und Erkrankungsdauer. Das heißt: Je geringer der Sauerstoffgehalt des Blutes bzw. je länger die Erkrankung andauerte, desto stärker die Hirnschädigungen.
Obwohl auch eine Kontrolle verschiedener kognitiver Leistungen erfolgte, bei denen die von COPD Betroffenen deutlich schlechter abschnitten, wurden die Probanden bedauerlicherweise nicht hinsichtlich affektiver Störungen untersucht.
Für die Interpretation auf kausaltheoretischer Grundlage spielt das jedoch keine Rolle, denn aufgrund der festgestellten Schädigungen in mehreren affektrelevanten Hirnregionen ist von entsprechenden Auswirkungen auf die Entstehung oder Intensivierung von Affektstörungen auszugehen.
Erkrankungsunabhängiger Sauerstoffmangel und Depression in der Empirie
Erfreulicherweise kann an dieser Stelle aus zwei Studien zitiert werden, bei denen Zusammenhänge zwischen erkrankungsunabhängigem Sauerstoffmangel und einer Depression untersucht wurden.
In einer 2006 durchgeführten finnischen Studie untersuchten Tommi Tolmunen und sein Team bei 1.519 psychisch gesunden männlichen Probanden im Alter zwischen 46 und 61 Jahren die Auswirkungen unterschiedlich starker Sauerstoffaufnahmen auf die Stimmung (Quelle: T. Tolmunen et al., Low maximal oxygen uptake is associated with elevated depressive symptoms in middle-aged men, European Journal of Epidemiology, 2006, 21: S. 701 ‑ 706, http://deepblue.lib.umich.edu/bitstream/...).
Die Probanden unterzogen sich einem zweistündigen Belastungstest auf dem Fahrradergometer mit einer parallelen Analyse ihrer Atemgase. Die gesamte Kohorte wurde in Abhängigkeit von der Sauerstoffaufnahme der einzelnen Teilnehmer in Quartile unterteilt, so dass sich vier statistisch zusammengehörige Gruppen ergaben. Anschließend erfolgte eine Befragung und Einschätzung der depressiven Symptomatik mit Hilfe des HPL-Index. Die Teilnehmer mit der jeweils geringsten Sauerstoffaufnahme, die dem untersten Quartil zugeordnet waren, hatten ein dreifach erhöhtes Risiko für Symptome einer Depression in Relation zu denen aus dem obersten Quartil.
In einer Tierversuchsstudie von Shami Kanekar aus dem Jahre 2015 (Quelle: S. Kanekar et al., Thin air, high altitudes cause depression in female rats, 2015, University of Utah Health Science - U of U, Salt Lake City, Utah, USA, https://medicalxpress.com/news..) wurden die Wirkungen unterschiedlicher Höhenlagen untersucht, wobei die reduzierte Sauerstoffaufnahme im Mittelpunkt stand, denn in Hochlagen, vor allem im Gebirge ab etwa 3.000 Metern, ist aufgrund der reduzierten Luftdruckverhältnisse die Sauerstoffaufnahme behindert. Es ging dabei um die Frage, ob dieser Umstand einen eigenständigen Risikofaktor für die Entstehung einer Depression bedeutet.
Die Studie wurde mittels Höhenkammern durchgeführt, die Meereshöhe, 3.048 Höhenmeter und 6.069 Höhenmeter simulierten; als Versuchtstiere dienten männliche und weibliche Ratten. Der Grad eines mit einer Depression vergleichbaren Verhaltens der Tiere wurde laut Aussage der Studienleiterin mit Hilfe eines renommierten Ausdauerverhaltenstests gemessen. Die Resultate waren eindeutig: Weibliche Ratten zeigten mit zunehmender Höhe depressives Verhalten. Erstaunlicherweise zeigten die männlichen Tiere unter denselben Bedingungen kein derartiges Verhalten.
Dass die Studie im US-amerikanischen Bundesstaat Utah durchgeführt wurde, ist kein Zufall, denn die westlichen Bergregionen der Vereinigten Staaten verzeichnen auffällig höhere Suizidraten als der Rest des Landes. 2012 lag die Suizidrate der Bundesstaaten Utah, Colorado, Wyoming, Montana, Idaho, Nevada, Arizona und New Mexico mit 18 deutlich über dem Bundesdurchschnitt von 12 pro 100.000 Einwohnern. Daher hat diese Region auch ihren traurigen Ruf als „Suicide Belt“ der USA. Daraus lässt sich natürlich nicht eindeutig auf eine Kausalbeziehung zwischen beiden Merkmalen schließen, jedoch ist der Zusammenhang bemerkenswert und könnte auf eine solche hindeuten.
In einem Science-Newsline-Artikel anlässlich der Kanekar-Studie, der aktuell leider nicht mehr abrufbar ist, wurde auch auf andere Studien verwiesen, die zu ähnlichen Ergebnissen führten: „Mehrere Studien (...) deuten darauf hin, dass Höhe ein unabhängiger Risikofaktor für Selbstmord ist und dass die Häufigkeit der Depression ebenfalls mit der Höhe positiv korreliert und zum erhöhten Selbstmordrisiko beiträgt. (...)" (Quelle: https://sciencenewsline.com).
Erkrankungen des Atemsystems, Sauerstoffmangel und Depression in der Empirie
Bei den Erkrankungen des Atemsystems und möglichen Zusammenhängen mit einer Affektstörung bzw. Depression stehen die COPD und das Schlafapnoë‑Syndrom im Mittelpunkt des Interesses.
Dass es zwischen den chronisch obstruktiven Lungenerkrankungen, kurz COPD, und der Depression einen eklatanten Zusammenhang gibt, gehört in der Lungenmedizin mittlerweile zum Allgemeinwissen. In zahlreichen Artikeln wird über dieses Thema berichtet und aus verschiedenen Studien zitiert. Dabei werden jedoch häufig kausale Zusammenhänge zwischen den allgemeinen schlechten Lebensumständen von COPD-Betroffenen und dem Entstehen einer Depression konstruiert (→ Quelle: http://www.leichter-atmen.de/copd-depression).
Ein solcher Zusammenhang kann bei der Krankheitsgenese tatsächlich ein Rolle spielen. Der organisch-physiologische Aspekt jedoch, also die zu Hirnschäden führende chronische Sauerstoffunterversorgung, wird in der Regel als mögliche Ursache überhaupt nicht in Erwägung gezogen. Sie ist auf Basis der hier diskutierten kausaltheoretischen Modelle jedoch die logischere Erklärung.
Das Hauptergebnis einer in Neuseeland im Jahre 2010 von Emma Mold durchgeführt Studie mit insgesamt 63 schwerkranken COPD‑Patienten, davon 36 Frauen, war eine Prävalenzrate für eine Depression von 54%. Mit Hilfe eines Fragebogenverfahrens wurden 25% der Patienten als leicht depressiv, 29% sogar als mittelschwer bis schwer depressiv eingestuft. Knapp 17% der Depressiven befanden sich deswegen in einer Behandlung (Quelle: E. Mold, The Prevalance of Depression amongst People with Chronic Obstructive Pulmonary Disease on Long Term Oxygen Therapy, 2010, Victoria University of Wellington/New Zealand, http://researcharchive.vuw.ac.nz/...).
Im Mai 2011 veröffentlichten M. W. Zhang und Team die Ergebnisse einer Meta-Analyse, bei der acht vergleichbare Studien aggregiert wurden, welche die Untersuchung des Zusammenhangs zwischen COPD und Depression zum Thema hatten (Quelle: Zhang, Ho, Cheung, Fu, Mak, Prevalence of depressive symptoms in patients with chronic obstructive pulmonary disease: a sytematic review, meta-analyses and meta-regression, 2011, Department of Psychological Medicine, Yong Loo Lin School of Medicine, National University of Singapore, http://www.ncbi.nlm.nih.gov/...).
Durch die Aggregation von acht Einzelstudien konnten insgesamt 79.018 Personen einbezogen werden, dabei handelte es sich um 39.587 an COPD erkrankte Personen, die mit 39.431 gesunden Kontrollprobanden verglichen wurden. Die Prävalenzraten der COPD-Patienten zu Gesunden betrugen insgesamt 25,6% : 11,7% bei einer hohen Ergebniswahrscheinlichkeit (CI) von 95%. Die in den einzelnen Studien ermittelten Prävalenzraten wichen stark voneinander ab, sie lagen bei den COPD-Patienten zwischen 20,0 und 28,6% und bei den Gesunden zwischen 9,0 und 15,1%.
Was für die COPD schon länger gilt, trifft mittlerweile auch auf Schlafapnoë zu, denn Wissenschaftler haben aufgrund zahlreicher Studien und Forschungen genügend Anhaltspunkte dafür, dass es hier signifikante Zusammenhänge mit einer Affektstörung bzw. Depression gibt.
Da sich die Schlafapnoë jedoch meist unbemerkt entwickelt, fällt die Erklärungsmöglichkeit fort, die bei der COPD für das Entstehen der Depression oft herhalten muss, denn die Betroffenen müssen sich nicht tagtäglich mit einer der COPD vergleichbar belastenden Erkrankung „herumschlagen“. Häufig wird jedoch mit der Unausgeschlafenheit argumentiert, die dann zu depressiven Stimmungen führe, was für sich alleine genommen jedoch eine gewagte Vermutung bleibt. Auf jeden Fall ist auch bei der Schlafapnoë der Sauerstoffmangel die näherliegende Erklärung für die Entstehung affektiver Störungen. Aber was findet man dazu in der Empirie?
Bei einer von F. Rezaeitalab et al. zwischen September 2008 und Mai 2012 durchgeführten Langzeitstudie mit 178 erwachsenen Schlafapnoë-Patienten, Durchschnittsalter knapp über 50 Jahre, wurden die Teilnehmer anhand gängiger Scoring-Verfahren beurteilt (Quelle: F. Rezaeitalab et al., The correlation of anxiety and depression with obstructive sleep apnea syndrome, 2014, School of Medicine, Mashhad University of Medical Sciences, Mashhad/Iran, University of Sydney, Sydney/Australia, http://www.ncbi.nlm.nih.gov/...). Die Schweregrade ihrer Depression bzw. Angstzustände wurden mittels BAI/BDI (Beck Anxiety/Depression Inventory) gemessen, der Grad ihrer Atemstörung mit einer Polysomnographie-Messung und Bewertung anhand des AHI (Apnoë-Hypopnoë-Index). Ebenfalls ermittelte man die Tagesmüdigkeit, wobei hier die Epworth Sleepiness Scale (ESS) zum Zuge kam.
Die Männer waren hier stark in der Überzahl, denn sie stellen 85,5% der Teilnehmerzahl. Allerdings sind von der Erkrankung auch überwiegend Männer betroffen, vor allem solche, die übergewichtig sind. In den Studienergebnissen waren keine Zusammenhänge zwischen den Symptomen der Schlafapnoë und dem Geschlecht festzustellen, so dass dieser Umstand auch nicht von Bedeutung ist.
Affektstörungen waren unter den Teilnehmern auffällig verbreitet, denn im Schnitt klagten 53,9% der Teilnehmer über Angstzustände und 46,1% über Symptome einer Depression.
Interessant sind die Zusammenhänge mit der Schwere der Erkrankung, die anhand der schon erwähnten Messungen ausreichend exakt bestimmt werden konnten. Es mehrten sich Angstzustände, je schwerer die Erkrankung eingestuft wurde, wobei diese auch mit der Zahl der Erstickungsanfälle korrelierte. So litten von den schwer Erkrankten 66,7% unter Ängsten und 71,4% unter Erstickungsanfällen, während nur 23,1% davon Tagesschläfrigkeit angaben.
Fazit: Die Studie von Rezaeitalab widerlegt die These, dass Probleme mit der Tagesschläfrigkeit in einem signifikanten Zusammenhang mit den affektiven Störungen stehen, während ein Zusammenhang mit der Erkrankungsschwere offensichtlich ist.
Im Rahmen des NHANES-Programms (National Health and Nutrititon Examination Survey) der Vereinigten Staaten wurden von Anne G. Wheaton und ihrem Team zwischen 2005 und 2008 zum ersten Mal landesweite Befragungen zur Schlafapnoë, Rhonchopathie und Depression durchgeführt. Eine hohe Anzahl von 9.714 Erwachsenen gaben Auskünfte über ihr Schlafverhalten und die genannten Schlafstörungen. Die Befragungen wurden statistisch aufbereitet, so dass andere Faktoren, beispielsweise Gewicht, Alter oder Geschlecht, berücksichtigt wurden (Quelle: Anne G. Wheaton et a., Sleep Disordered Breathing and Depression among U.S. Adults: National Health and Nutrition Examination Survey, 2005 - 2008, Division of Adult and Community Health, National Center for Chronic Disease Prevention and Health Promotion, Centers for Disease Control and Prevention, Atlanta/GA, USA, http://www.ncbi.nlm.nih.gov/pmc/...).
Männer und Frauen mit schwerer Schlafapnoë, die mindestens fünfmal pro Woche Atemausfälle hatten, zeigten dabei dreimal so häufig Anzeichen einer schweren Depression. Wheaton schloss daraus, dass sowohl der Sauerstoffmangel als auch die Schlafunterbrechungen Ursachen dafür sein könnten und regte auf diesem Gebiet mehr Forschungstätigkeit an.
In dem Artikel auf der Web-Seite WebMD Health News, bei dem es um die Wheaton-Studie ging, wurde auch Paul Macey zitiert, ein wissenschaftlicher Mitarbeiter des UCLA School for Nursing and Brain Research Institute in Los Angeles/USA. Er vermutete einen kausalen Zusammenhang zwischen einer Schlafapnoë und einer Depression und begann damit, Patienten nach dem Zeitpunkt der Diagnosestellung bzw. des Auftretens beider Erkrankungen zu befragen. Zu seiner Überraschung konnte er anhand der Aussagen keinen Zusammenhang feststellen. Jedoch ist die Qualität und der Umfang seiner Befragungen unbekannt und man muss berücksichtigen, dass die Schlafapnoë in der Regel fast immer erst nach sehr langer Zeit diagnostiziert wird, was den Aussagewert seiner Befragungen drastisch reduziert, wenn nicht sogar irrelevant werden lässt (Quelle: Rita Rubin, Sleep Apnea Linked to Depression, http://www.webmd.com/sleep-disorders/...).
Etwa parallel im Jahre 2006 veröffentlichten Paul Peppard und seine Mitarbeiter die Ergebnisse einer aufwändigen Studie, an der 788 Männer und 620 Frauen teilnahmen (Quelle: Paul Peppard et al., Longitudinal association of sleep-related breathing disorder and depression, Dept. of Population Health Sciences, 2006, University of Wisconsin-Madison, Madison/WI, USA, http://www.ncbi.nlm.nih.gov/...).
Peppard und sein Team verwendeten den Apnoë-Hypopnoë-Index (AHI) und definierten drei Schweregrade der Schlafstörung: 0 = gesund, 0 < AHI 1 < 5 = minimal, 5 < = AHI 2 < 15 mild und ein AHI 3 > 15 wurde als mittelgradig bis schwer bewertet. Als depressiv eingestuft wurde man bei einem Wert > 50 auf der Zung-Skala oder bei Einnahme von Antidepressiva. Es wurden Langzeitdaten mit 4‑Jahres‑Intervallen ausgewertet, die für alle Studienteilnehmer vorlagen.
Im Schnitt stieg das Risiko der Schlafapnoë-Patienten, an einer Depression zu erkranken, um das 1,8-fache im Vergleich zu Gesunden, wenn man in der AHI-Skala eine Kategorie höher bewertet wurde. Betrachtet man die Risiken zwischen den AHI-Kategorien im Einzelnen, ergab sich eine kontinuierliche Steigerung von AHI 1 bis AHI 3. So betrug das Erkrankungsrisiko beim Wechsel von 0 auf AHI 1 das 1,6-fache, von AHI 1 auf AHI 2 das 2,0-fache und von AHI 2 auf AHI 3 das 2,6-fache.
Die Reaktion auf diese Studie war positiv, zum Beispiel in der Pharmazeutischen Zeitschrift: „Je stärker die Schlafstörung des Patienten, desto größer das Risiko, eine Depression zu entwickeln. Letztere kann dabei nicht Auslöser der Atmungsstörung sein, da Schlafapnoe in der Regel auf physische Faktoren zurückzuführen ist, wie etwa stark ausgeprägte Mandeln bei einer gleichzeitig relativ schmalen Luftröhrenöffnung. »Solche Studien stellen die ursprüngliche und lange vorherrschende Sichtweise völlig auf den Kopf«, sagt Professor Dr. Dieter Riemann, Psychologe und Schlafwissenschaftler an der Universität Freiburg. (...) Riemann hält zwei Theorien für möglich, warum gestörter Schlaf die Gefahr einer Depression deutlich erhöht. Aus verhaltenstherapeutischer Sicht entwickele sich letztendlich eine Form von Hilflosigkeit. »Man schläft schlecht, versucht dagegen anzugehen, schafft es aber nicht. Dieser Zustand führt schließlich zu einer depressiven Verstimmung«, beschreibt Riemann. Biologisch betrachtet lässt sich bei Depression und Schlafstörung der gleiche zentrale Prozess erkennen: die erhöhte Ausschüttung von Cortisol. »Das versetzt den Körper in den Zustand einer Stresssituation«, sagt Riemann. Physische sowie psychische Belastungen seien die Folge. Hinzu komme die genetische Veranlagung einiger Menschen. »Sie sorgt dafür, dass sich die Stresssituation nicht zurückbilden kann, wie dies normalerweise der Fall ist.«“ (Quelle: Pharmazeutische Zeitung online, 35/2009, http://www.pharmazeutische-zeitung.de/...).
Riemanns biologische Sicht ist interessant, denn er beschreibt ein realistisches Stressszenario, leider ohne einzelne Stressmechanismen und -auswirkungen exakter zu benennen. Als ein weiterer biologisch-physiologischer Grund wäre der Sauerstoffmangel an sich zu nennen, der Hirnschädigungen direkt oder über eine Kausalkette zur Folge haben kann. Auch von Riemann wird dieser naheliegende Grund leider nicht gesehen. Die alternative von ihm geäußerte verhaltenspsychologisch begründete Argumentation kann nach den hier vertretenen Thesen nicht primär für eine Depression verantwortlich sein, wohl aber für eine depressive Verstimmung; diese Vermutung steht ebenfallls mit kausaltheoretischen Ansichten nicht im Widerspruch.
Von einer ganz anderen Perspektive sind die beiden Schlafforscher Daniel J. Schwartz und Gillian Karatinos aus Florida/USA an die Thematik herangegangen. Sie haben mit ihrer im April 2007 vorgestellten Studie nachweisen können, dass sich die Symptome einer Depression bei Schlafapnoë-Patienten mit Hilfe einer in der Nacht anzuwendenden Atemmaske plus Überdruck-Atemgerät verringern lassen. Insgesamt nahmen 102 Patienten an der Studie teil, von denen auffällig viele Symptome einer Depression angaben. 41% hatten laut dem schon erwähnten Beck Depression Inventory (BDI) eine leichte Depression, 12% eine mittelschwere bis schwere Depression.
Die Studie lief ein Jahr und umfasste nach Start zwei Befragungen, wobei die erste vier bis sechs Wochen nach Therapiebeginn stattfand (short-term follow-up) und die zweite Befragung nach einem Jahr durchgeführt wurde (long-term follow-up). Sowohl bei der ersten als auch bei der zweiten Befragung ergaben sich signifikante Verbesserungen der depressiven Symptomatik (Quelle: Daniel J. Schwartz, M.D., Gillian Karatinos, M.D., For Individuals with Obstructive Sleep Apnea, Institution of CPAP therapy is Associated with an Amelioration of Symptoms of Depression which is Sustained Long Term, 4/2007, The Sleep Center, University Community Hospital, Tampa/Florida, USA, JCSM Journal of Clinical Sleep Medicine, Vol. 3, No. 6, 2007, S. 631 ‑ 635, http://www.aasmnet.org/jcsm/...).
4.9.4 Fazit: Sauerstoffmangel und Affektstörungen
Molekularer Sauerstoff (O2) gelangt über Lunge und Blutkreislauf ins zentrale Nervensystem. Da Sauerstoff nicht gespeichert werden kann, eine extrem hohe Bedeutung für die Energieversorgung hat und immer in ausreichender Menge vorhanden sein muss, sind sämtliche Elemente der Sauerstoffversorgungskette entsprechend bedeutend:
- Sauerstoffgehalt der Luft
- Luftdruck
- Funktionsfähigkeit des menschlichen Atemsystems, beispielsweise Lunge, Zwerchfell (Aktivatmung)
- Situation bei Passivatmung, beispielsweise durch Sauerstoffgeräte/Beatmung
- Regelkreis des zerebralen Blutflusses
- Sauerstoffaufnahmefähigkeit/-abgabefähigkeit des Blutes
- Qualität des Herz-Kreislauf-Systems, insbesondere der Zustand zuführender arterieller Hirngefäße
Besondere Aufmerksamkeit sollte sämtlichen Erkrankungen des Atemsystems zuteilwerden, mit denen eine eingeschränkte Sauerstoffaufnahme verbunden ist, ebenfalls Herz‑Kreislauf‑Erkrankungen:
- COPD mit chronischer Bronchitis und Lungenemphysem
- Schlafapnoë-Syndrom
- Obstruktive Rhonchopathie
- Arteriosklerose hirnzuführender Blutgefäße
- Erkrankungen insbesondere kleinerer Arterien (Arteriolen) und Kapillargefäßen
Aus kausaltheoretischer Sicht (→ Kapitel 1, Abschnitt 1.5) können Affektstörungen entstehen oder bestehende Affektstörungen sich verstärken, wenn affektrelevante Hirnareale kurz-, mittel- oder langfristig von Sauerstoffmangel betroffen sind:
- Affektrelvante Bereiche des assoziativen Cortex
- Gyrus cinguli
- Gyrus parahippocampalis (?)
- Basalganglien
- Amygdala
- Hippocampus mit Fornix
- Mamillarkörper (?)
- Zwischenhirn mit Thalamus und Hypothalamus
- Mittelhirn
- Hypophyse
- Epiphyse
- Bereiche, die durch das Nervenetz der Formatio reticularis miteinander verknüpft sind
Untersuchungen bzw. Studien über Zusammenhänge zwischen Sauerstoffmangel und Affektstörungen sind rar. Bei vielen Forschungen steht die Schlafapnoë im Mittelpunkt.
Die Ergebnisse diverser Studien bestätigen Zusammenhänge zwischen Sauerstoffmangel(‑erkrankungen) und Affektstörungen.
Besondere Relevanz des Kausalfaktors Sauerstoff für Affektstörungen?
Die mittlere Bewertung des Kausalfaktors Sauerstoff bzw. Sauerstoffmangels als potentieller endogener Auslöser allgemeiner Zellprozessstörungen (→ Abschnitt 3.4.2) bestätigt sich auch im Zusammenhang mit der besonderen Rolle bei Affektstörungen:
- Sauerstoff ist als Energieträger im zentralen Nervensystem unverzichtbar.
- Sauerstoff ist nicht speichbar und muss daher immer verfügbar sein.
- Die Sauerstoffversorgungsqualität ist hauptsächlich von nicht beeinflussbaren äußeren und innern Umständen abhängig und entzieht sich zum größten Teil einer bewussten Steuerung.
- Die Ergebnisse der wenigen zur Verfügung stehenden Studien lassen Annahmen kausaler Zusammenhänge zwischen Sauerstoffmangel und Affekterkrankungen zwar nicht eindeutig zu, solche aber als wahrscheinlich erscheinen.
- Eine Höherbewertung der Relevanz des Sauerstoffs bzw. Sauerstoffmangels für die Genese von Affektstörungen ist aufgrund der besonderern Bedeutung dieses Kausalfaktors vertretbar.
4.10 Mangel oder Schäden an ncRNA-Molekülen und Affektstörungen ▲
Zwei unterschiedliche ncRNA-Molekülarten zum Aufbau von Proteinen
Nicht-codierende Ribonukleinsäuren (ncRNA) werden als einzige Substanzen aus der Gruppe stoffwechselaktiver Kausalfaktoren vollständig eigenständig mittels DNA-Transkription im Zellkern synthetisiert. Alle anderen stoffwechselaktiven Kausalfaktoren, also Aminosäuren, Mikronährstoffe, Fette bzw. Fettbegleitstoffe, Wasser, Glukose und Sauerstoff, gelangen hauptsächlich durch Nahrungsaufnahme oder Atmung von außen in den Körper und die Zellen.
Der Begriff „ncRNA“ ist eine Sammelbezeichung mehrerer Substanzengruppen, von denen die meisten durch unzählige verschiedene Einzelmoleküle repräsentiert werden. In Tabelle 18 unten sind einige Arten kurz beschrieben.
Zur ncRNA‑Gruppe gehören zum Beispiel Primer‑RNA, die als Startmoleküle für die DNA‑Replikation benötigt werden. Primer‑RNA sind eine Voraussetzung der Zellteilung.
Die meisten nicht‑codierenden Ribonukleinsäuren sind jedoch für die Proteinbiosynthese zuständig, indem sie diese entweder (1.) aktiv durchführen oder (2.) aktiv regulieren. Es existieren somit zwei Gruppen von ncRNA, deren Tätigkeiten Voraussetzungen für die Herstellung sämtlicher Zellproteine sind und die im Gegensatz zur codierenden Boten‑RNA (messenger‑RNA) stehen. Boten‑RNA dienen lediglich passiv zur Übersetzung des DNA‑Codes in Aminosäurenketten:
- Einige der für die Durchführung der Proteinbiosynthese notwendigen ncRNA sind schon länger bekannt. Francis Crick, der zusammen mit James Watson im Jahre 1953 die Struktur der DNA‑Doppelhelix entdeckte, postulierte schon bald darauf die Existenz von Transfer‑RNA, deren Strukturen und Funktionen sich im Zusammenhang mit der Erforschung der Aminosäurenkettenbildung (Translation) ab den frühen 1960er Jahren teilweise klärten.
Auch ribosomale RNA (rRNA) und Small nuclear RNA (snRNA) sind für die Durchführung der Translation bzw. Spleißprozesse von grundlegender Bedeutung und gehören damit ebenfalls zu den die Proteinbiosynthese durchführenden ncRNA.
Funktionen und Arbeitsweisen dieser Moleküle werden nur grundlegend verstanden, es besteht ein entsprechend hoher Forschungsbedarf. Einzelheiten dazu sind Inhalte von Abschnitten des zweiten Kapitels, in dem ein Zellprozessmodell konstruiert wird (→ Abschnitt 2.2.2), und im Abschnitt über den Spleißprozess (→ Abschnitt 3.3.5).
- Auf welche Weisen ncRNA‑Moleküle die Proteinbiosynthese modulieren (Genregulation), ist zum größten Teil noch Gegenstand der Grundlagenforschung, liegt deren Entdeckung doch erst wenige Jahre zurück. Zur Gruppe genregulierender ncRNA gehören u. a. micro‑RNA, piwi‑interacting RNA und circular RNA.
In den Abschnitten 2.2.3 bis 2.2.5 werden genregulierende Prozesse mit Beteiligung von ncRNA-Molekülen auf verschiedenen Ebenen der Proteinbiosynthese beschrieben.
TABELLE 18: ÜBERSICHT VERSCHIEDENER NICHT-CODIERENDER RIBONUKLEINSÄUREN
Bezeichnung |
Kurzform |
Aufgabe |
Derzeit bekannte Funktionen und Besonderheiten |
|---|---|---|---|
| Primer-RNA |
Primer | DNA- Replikation |
- Werden bei der Zellteilung zur DNA-Verdopplung benötigt - Bestehen nur aus etwa zehn Nukleotiden |
| Ribosomale RNA |
rRNA | Durchführung der Proteinbio- synthese |
- Sind Bestandteile der Untereinheiten von Ribosomen - Sind für die Translation der Peptidkette erforderlich - Es gibt wahrscheinlich drei oder vier Arten von rRNA-Molekülen - Ein hoher Anteil der RNA einer Zelle besteht aus rRNA - rRNA sind mehrfach auf der DNA codiert - rRNA sind noch weitgehend Gegenstände der Forschung |
| Transfer-RNA | tRNA | Durchführung der Proteinbio- synthese |
- Dienen, wie die rRNA, der Translation - Schaffen die Aminosäuren zu den Ribosomen - Verlinken mRNA mit einzelnen Aminosäuren - Es sollen maximal 41 verschiedene tRNA-Moleküle existieren |
| Small nuclear RNA | snRNA | Hauptsächlich Durchführung der Proteinbio- synthese |
- Maßgeblich am Spleißprozess beteiligt - Erkennen die Introns der unreifen mRNA - Regulieren einige proteinsyntheserelevante Enzyme - Stabilisieren die Chromosomenenden (Telomere) - Sind im Schnitt 150 Nukleotide lang |
| Small nucleolar RNA | snoRNA | Durchführung der Proteinbio- synthese |
- Gehören zur Gruppe der snRNA - Sind an der Synthese von ncRNA beteiligt - Modifizieren rRNA, tRNA und snRNA |
| Short interfering RNA | siRNA | Modulation der virusbedingten Proteinsynthese |
- Werden aus eingedrungener Viren-RNA synthetisiert - Mit siRNA bekämpft die Zelle fremde Viren-RNA - Stoppen die virusbedingte Proteinbiosynthese - Können auch künstlich synthetisiert werden - siRNA sind noch weitgehend Gegenstände der Forschung |
| Micro-RNA | miRNA | Modulation der zellspezifischen Proteinsynthese |
- Dominieren die Genregulation - Haben eine Länge von ca. 21 bis 23 Nukleotiden - Zahlreiche zelltypspezifische Formen - miRNA sind noch weitgehend Gegenstände der Forschung |
| Piwi-interacting RNA | piRNA | Modulation der zellspezifischen Proteinsynthese |
- Ausschließlich in männlichen Geschlechtszellen aktiv - Haben miRNA-vergleichbare Aufgaben - Sind ca. 26 bis 31 Nukleotide lang - piRNA sind noch weitgehend Gegenstände der Forschung |
| Circular RNA | circRNA | Modulation der zellspezifischen Proteinsynthese |
- circRNA binden vermutlich an miRNA - Genregulieren vermutlich gemeinsam mit miRNA - Vermutlich zahlreiche zelltypspezifische Formen - Sind weitgehend Gegenstände der Forschung (2013 entdeckt) |
| Antisense-RNA | aRNA | Modulation der zellspezifischen Proteinsynthese |
- aRNA werden vom komplementären DNA-Strang transkibiert - Spielen bei der Genregulation eine Rolle - Vermutlich zahlreiche zelltypspezifische Formen - Vermutlich unterschiedliche Nukleotidenanzahl möglich - Sind weitgehend Gegenstände der Forschung |
Tabelle 18: Eine Auswahl wichtiger Typen nicht-codierender Ribonukleinsäuren, die letzten vier Arten siRNA, miRNA, piRNA und circRNA gehören zu den wichtigsten Entdeckungen der letzten Jahrzehnte auf den Gebieten der Medizin und Biologie/Genetik. Mit Ausnahme von Primern und siRNA sind alle ncRNA an der Proteinbiosynthese durch ausführende oder genregulierende Aktivitäten beteiligt, wobei miRNA, piRNA und circRNA als genregulierende Substanzen überwiegend zelltypspezifisch tätig sind.
Drei Gründe, warum dysfunktionale nicht-codierende Ribonukleinsäuren gefährlich sind
Nicht-codierende Ribonukleinsäuren stellen die mit Abstand wichtigste Kausalfaktorgruppe dar. In einer Relevanzanalyse wurde daher auch deren im Vergleich mit anderen Kausalfaktoren wesentlich höheres Potential festgestellt, Zellprozesse bei Dysfunktionalität ‑ d. h. bei Mangel oder sonstigen Mängeln ‑ zu stören (→ Abschnitt 3.4), was vor allem auf drei ncRNA-Charakteristika zurückzuführen ist:
- Die Aktivitäten nicht‑codierender Ribonukleinsäuren betreffen ausschließlich die obere Zellprozessebene und dort vor allem die Genregulation. Genregulationsstörugen wirken sich fast immer gravierend auf die gesamte untere Zellprozessebene aus und führen dort zu Prozessproblemen.
- Die Synthese nicht‑codierender Ribonukleinsäuen erfolgt durch Transkription, die ncRNA‑Codes müssen auf der DNA zur Synthese abgelesen werden. Der ncRNA‑Status einer Zelle ist daher vor allem vom Zustand der DNA abhängig, die von Anzahl und Ausprägung somatischer Mutationen und Keimbahnmutationen negativ beeinflusst wird: Je mehr Mutationen die DNA aufweist, desto schlechter der ncRNA‑Status.
Sowohl somatische als auch Keimbahnmutationen sind so gut wie nicht im positiven Sinne manipulierbar und damit unvermeidlich. Insbesondere somatische DMutationen führen durch Fehleranhäufung bzw. Akkumulation im Laufe des Lebens fast unweigerlich zu einer immer höheren Anzahl von DNA‑Schäden, die vor allem Fehler bei der ncRNA‑Synthese zur Folge haben. Die immer massiver werdenen Versorgungslücken an ncRNA lässt die gesamte Genregulation immer stärker aus dem Ruder laufen und stellt einen wesentlichen Grund für Zellalterung, Krankheitsentstehung oder die Verstärkung bestehender Erkrankungen dar.
- Probleme mit der ncRNA‑Versorgung entziehen sich einer einfachen Beeinflussung von außen, denn aufgrund ihrer zelltypspezifischen Synthese können Mängel an ncRNA nicht durch simple Substitutionsmaßnahmen beseitigt werden, wie das bei anderen Kausalfaktoren, beispielsweise Wasser, Mikronährstoffen (Vitaminen, Mineralstoffen oder Spurenelementen) oder essentiellen Fettsäuren, der Fall ist.*
* Anmerkung: Im Kapitel 7 wird gezeigt, dass ncRNA dennoch substituiert werden können, in dem man sie am Verdauungssystem vorbei Körper und Zellen zelltypspezifisch parenteral zuführt.
4.10.1 Mutationen und nicht-codierende Ribonukleinsäuren
Zur besseren Einordnung eine Übersicht über verschiedene Mutationsauslöser und Zusammenhänge zwischen nicht-codierenden Ribonukleinsäuren und somatischen Mutationen bzw. Keimbahnmutationen in Kurzform (→ ausführlich in den vorherigen Abschnitten 4.2 und 4.7).
Auslöser somatischer Mutationen
Somatische DNA‑Mutationen resultieren aus Ereignissen, die sich während aller Lebenszyklen ‑ einschließlich der Embryonal‑ und Fetalphase ‑ in Zellen ereignen. Verschiedene Auslöser kommen hierfür infrage:
- Unabhängig von äußeren Einflüssen und ohne erkennbare Ursachen physiologische Ereignisse
- Replikationsbedingte Schäden aufgrund der DNA-Verdopplung kurz vor einer Zellkernteilung
- Oxidative Schäden durch freie Radikale oder reaktive Sauerstoff-Spezies (ROS), ausgelöst durch die natürliche Zellatmung oder verschiedene exogene Mutagene
- Exogene Noxen mit mutagener Wirkung, beispielsweise Gifte oder Radioaktivität
Auswirkungen somatischer DNA-Mutationen auf den Status nicht-codierender Ribonukleinsäuren
Sowohl Gene (Codes für kurze Peptidketten, Enzyme oder Proteine) als auch ncRNA‑Codes sind von Mutationen bedroht. Mutationen nicht‑codierender Ribonukleinsäuren oder von Proteinen bzw. Enzymen, die an der ncRNA‑Synthese beteiligt sind, haben potentiell ncRNA‑Strukturschäden oder einen ncRNA‑Mangel zur Folge, sofern es sich nicht um stille Mutationen handelt. Versorgungmängel nicht‑codierender Ribonukleinsäuren können zu Genregulationsstörungen ‑ d. h. Modulationsstörungen der Proteinbiosynthese ‑ führen.
Einige ncRNA verfügen redundant über mehrere Codes auf der DNA. Allerdings ist nicht geklärt, für welche ncRNA‑Codes dies im Einzelnen zutrifft. Mehrfach‑Codes sind beispielsweise für ribosomale RNA (rRNA) nachgewiesen. Ohne rRNA‑Moleküle ist keine Proteinbiosynthese möglich, darüber hinaus werden die Moleküle in hohen Mengen ständig benötigt. Durch mehrere identische rRNA‑Codes können nicht nur viele rRNA parallel produziert werden, im Falle der Mutation eines rRNA‑Codes käme dank weiterer intakter Codes auch nicht gleich die gesamte Proteinbiosynthese zum Erliegen, denn das hätte den sofortigen Zelltod zur Folge (Quelle: Lexikon der Biochemie ‑ Redundanz, Spektrum der Wissenschaft Verlagsgesellschaft mbH, Heidelberg 1999, http://www.spektrum.de/...).
Trotzdem ist die Wahrscheinlichkeit von ncRNA-Synthesestörungen nach somatischen Mutationen hoch, da Redundanzen wohl eher Ausnahmeerscheinungen und mit hoher Wahrscheinlichkeit nicht die Regel sind. Außerdem sind im Laufe der Zeit auch redundant vorliegende Codes vor Mutationen nicht sicher.
Eine gestörte ncRNA‑Synthese kann erhebliche Konsequenzen haben, insbesondere dann, wenn das ncRNA‑Molekül für die Regulation eines besonders wichtigen Enzyms bzw. Proteins notwendig ist. Ebenfalls drohen ungünstige Multiplikatoreffekte: Genreguliert beispielsweise ein einziges micro‑RNA‑Molekül mehrere Enzyme oder Proteine, wirkt sich dessen Mangel oder Dysfunktionalität potentiell ungünstig auf alle von ihm zu regulierenden Enzyme und Proteine aus. Sind diese Enzyme und Proteine wiederum an besonders vielen und wichtigen Zellprozessen beteiligt, drohen weitere negative Multiplikatoreffekte auf der unteren Zellprozessebene. Ein verminderter Bestand oder das Fehlen bzw. die Funktionseinschränkung einer einzigen micro‑RNA hätte daher in mehreren Prozessbereichen das Potential, einen „Flächenbrand“ auszulösen.
Zusammenfassend lassen sich folgende Einflussfaktoren auf die Konsequenzen somatischer ncRNA-Mutationen differenzieren:
- Welche ncRNA-Gruppe (rRNA, tRNA, miRNA, circRNA etc.) ist betroffen?
- Wie groß ist die Strukturveränderung eines geschädigten ncRNA-Moleküls?
- Wie stark sinkt die ncRNA-Syntheserate eines bestimmten ncRNA-Moleküls?
- Wie bedeutend ist das von Dysfunktionalität betroffene ncRNA-Molekül hinsichtlich seiner Involvierung in die Synthese besonders vieler bzw. besonders wichtiger Peptide.
- Ist die jeweilige ncRNA (bzw. das ncRNA-relevante Gen) nur mit einem einzigen Code auf der DNA repräsentiert, oder gibt es Redundanzen und damit mehrere identische Codes?
- In welcher Lebensphase des Individuums sind mutationsbetroffene ncRNA genregulierend tätig? Hier sind die Embryonalphase, die Fetalphase und/oder nachgeburtliche Lebensphasen zu unterscheiden.
- Führen mutationsbedingte ncRNA-Mängel zum kontrollierten (p53-Apoptose) oder unkontrollierten (Zellnekrose) Abbau betroffener Zellen?
Abbildung 33 zeigt direkte (= kurzfristige) Mutationswirkungen am Beispiel ribosomaler RNA (rRNA), Transfer‑RNA (tRNA) und micro‑RNA (miRNA).
ABBILDUNG 33: UNMITTELBARE WIRKUNGEN SOMATISCHER MUTATIONEN VON rRNA, tRNA UND miRNA
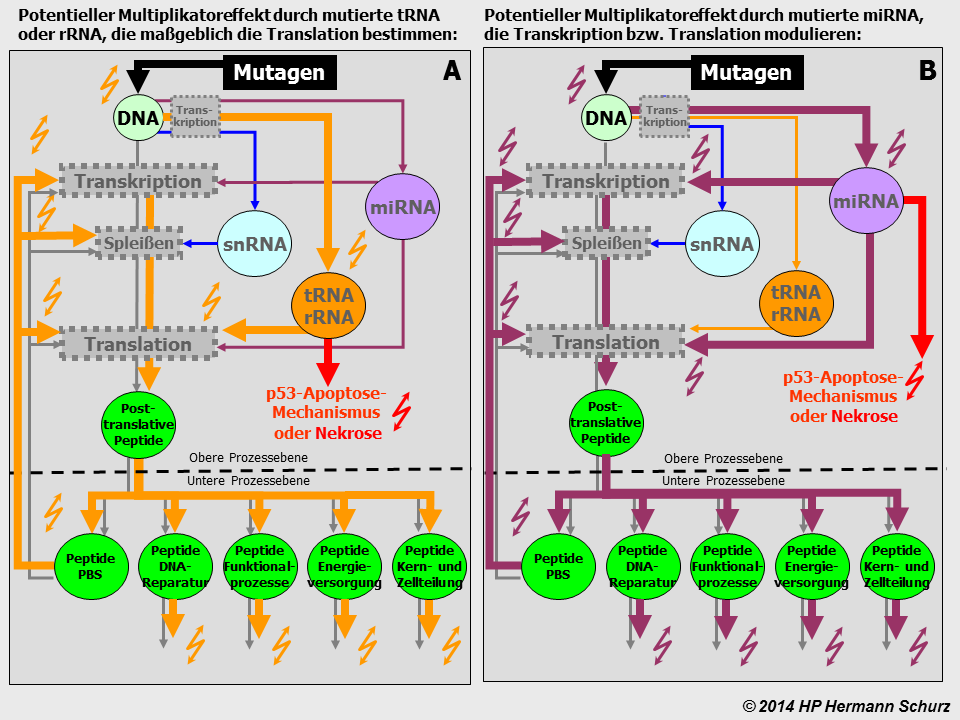
Abbildung 33: Somatisch mutierte ncRNA-Codes können erhebliche negative Auswirkungen haben, denn ncRNA-Moleküle erfüllen ihre Aufgaben vor allem bei der Proteinbiosynthese auf der oberen Zellprozessebene. Die Blitzsymbole verweisen auf die zahlreichen Bereiche, in denen fehlende oder fehlerhafte ncRNA Schäden anrichten können. Transfer-RNA und rRNA (Abbildung A links) sind für den Proteinsyntheseprozess während der Translation unverzichtbar; miRNA (Abbildung B rechts) dienen nach dem jetzigen Stand der Forschung der Proteinsynthesemodulation (Genregulation), mit hoher Wahrscheinlichkeit während der Transkription, aber ganz bestimmt während der Translation. Aus fehlenden oder fehlerhaften ncRNA resultieren daher potentiell negative Multiplikatoreffekte in sämtlichen Zellbereichen. Der p53-Apotose-Mechanismus schützt den Gesamtorganismus zwar vor Zellen mit besonders schwerwiegenden ‑ meist malignen ‑ Mutationen, in dem diese kontrolliert entsorgt werden, im ungünstigeren Fall findet eine unkontrollierte Nekrose statt. Bei ungenügender oder sogar fehlender Fähigkeit zur Zellneubildung, wie beispielsweise in vielen Bereichen des Zentralnervensystems, kann auch Zellschwund langfristig Probleme und Erkrankungen zur Folge haben (über die Folgen von p53‑Apoptose und Zellnekrose→ Abschnitt 4.10.2).
Ursachen von Keimbahnmutationen
Vor oder unmittelbar während der Keimzellenverschmelzung auftretende Keimbahnmutationen findet man später logischerweise in allen Zellen des Organismus. Keimbahnmutationen werden nach ihrer Ursache unterschieden:
- Erbliche Mutationen innerhalb einer abgrenzbaren Population, beispielsweise einer Familie oder Sippe, die mindestens seit einer Generation im Erbgut fest nachweisbar sind und einem genauen und nachvollziehbaren Vererbungsschema (Erbgang) folgen
- Spotane oder durch exogene Noxen ‑ beispielsweise radioaktive Strahlung ‑ ausgelöste Mutationen in einzelnen mütterlichen oder väterlichen Keimzellen
- Mutationen, die während der Keimzellenverschmelzung spontan entstehen
Auswirkungen von Keimbahnmutationen auf den Status nicht-codierender Ribonukleinsäuren
Keimbahnmutierte ncRNA-Codes und ncRNA-relevante Gene können zu Mangel oder Strukturschäden an ncRNA-Molekülen führen. Daraus können wiederum Proteinbiosynthesestörungen resultieren, beispielsweise aufgrund von Genregulationsstörungen, falls micro-RNA betroffen sind.
In formaler Hinsicht unterscheiden sich Keimbahnmutationen nicht von somatischen Mutationen. Im Gegensatz zu somatischen Mutationen betreffen Keimbahnmutationen jedoch immer sämtliche Zellen des fertigen Organismus und werden überall dort, wo die mutierten Codes ausgelesen werden, zum Problem. Das kann dazu führen, dass ein oder auch mehrere Organe vollständig mutationsgeschädigt sind.
Die Folgen von ncRNA-Keimbahnmutationen hängen von Umständen ab, die schon bei somatischen Mutationen eine Rolle spielten:
- Welche ncRNA-Sorte (rRNA, tRNA, miRNA, circRNA etc.) ist betroffen?
- Wie groß ist der Strukturschaden am ncRNA-Molekül?
- Wie hoch ist der Rückgang der Syntheserate für das jeweilige ncRNA-Molekül?
- Wie bedeutend ist das von der Mutation betroffenen ncRNA-Molekül? Ein ncRNA-Molekül ist umso bedeutender, je umfassender es in die Zellabläufe involviert ist, zum Beispiel durch die Beteiligung an der Regulation besonders vieler und/oder besonders wichtiger Peptide
- Wird die jeweilige ncRNA (bzw. das ncRNA-relevante Gen) mit nur einem einzigen Code oder mehreren redundanten Codes auf der DNA repräsentiert und gibt es noch intakte Codes?
- In welcher Lebensphase beeinflusst die Keimbahnmutation die Entstehung oder Funktionsfähigkeit des Organismus (Embryonalphase, Fetalphase und/oder nachgeburtliche Lebensphasen)?
- Führen mutationsbedingte ncRNA-Mängel zum kontrollierten (p53-Apoptose) oder unkontrollierten (Zellnekrose) Abbau betroffener Zellen?
Aufgrund der formalen Parallelen zwischen somatischen Mutationen und Keimbahnmutationen besteht aus Prozesssicht kein großer Unterschied zwischen beiden, so dass Abbildung 34 kaum von der vorhergehenden abweicht.
ABBILDUNG 34: AUSWIRKUNGEN VON rRNA-, tRNA- UND miRNA-KEIMBAHNMUTATIONEN
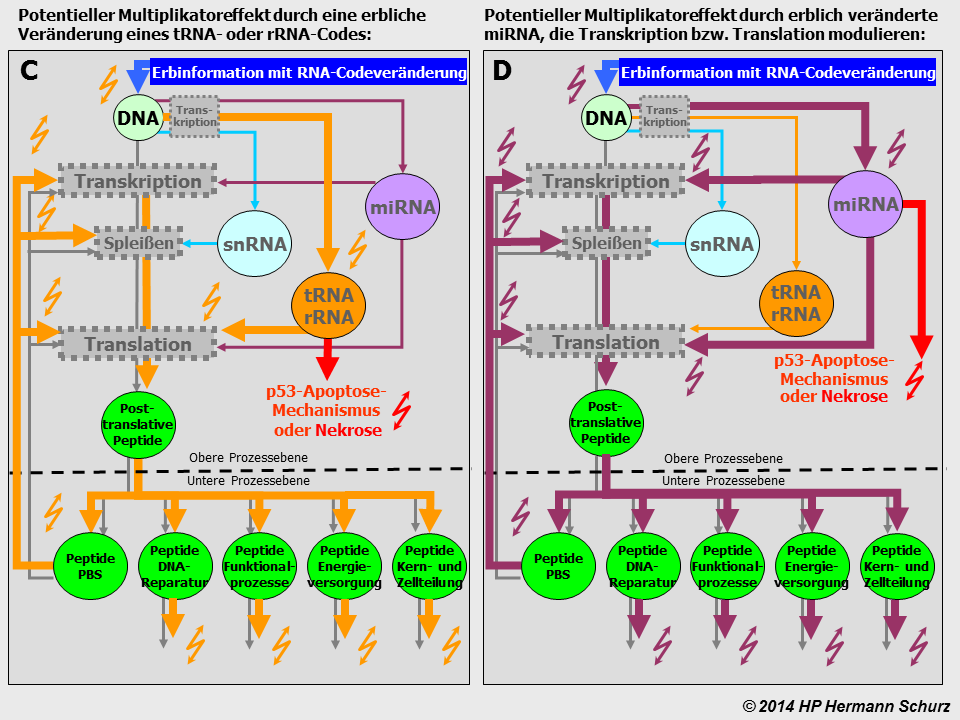
Abbildung 34: In beiden Teilgraphiken sind die Folgen keimbahnmutationsbedingter Veränderungen an ncRNA-Codes beispielhaft für ribosomale RNA (rRNA) und Transfer-RNA (tRNA) in Abbildung C und micro-RNA (miRNA) in Abbildung D dargestellt. Wie bei somatischen Mutationen drohen auch hier Multiplikatoreffekte auf sämtlichen Zellprozessbereichen in Abhängigkeit von der Bedeutung des jeweils geschädigten ncRNA-Moleküls. Aber nur dort, wo ncRNA-Codes ausgelesen werden müssen, stellen Keimbahnmutationen eine Gefahr dar. Keimbahnmutationen betreffen sämtliche Zellen des neu entstehenden Organismus, was bei somatischen Mutationen nicht der Fall ist.
4.10.2 Somatische Mutationen und Zentralnervensystem
Die Akkumulation somatischer Mutationen in einzelnen Zellen und der parallele Anstieg der Anzahl mutierter Zellen in einem zenralnervösen Zellverbund oder auch größeren Teil des Zentralnervensystems kann zu immer massiveren Zellprozessproblemen führen (→ Abschnitt 4.10.1):
- Mutationsveränderte ncRNA-Codes und Mutationen ncRNA‑syntheserelevanter Gene findet man im Laufe der Zeit in immer mehr Glia-, Nerven- und Blutgefäßzellen des Gehirns und Rückenmarks, auch die Anzahl mutationsbedingter Veränderungen innerhalb einzelner Zellen steigt dort stetig.
- Die Fähigkeit der Zellen des Zentralnervensystems, eine ausreichende Anzahl und den notwendigen Mix funktionsfähiger ncRNA zu synthetisieren, sinkt im Laufe der Zeit und führt zu steigenden ncRNA‑Fehlversorgungen, die vor allem mit Genregulationsstörungen bzw. Proteinbiosynthesestörungen in Gehirn und Rückenmark einhergehen.
- Aus Fehlmodulationen der Proteinbiosynthese resultieren Eiweißaufbaustörungen und es kommt zu pathologischen Veränderungen des Proteinprofils betroffener Zellen. Die Menge der Enzyme und Proteine ist reduziert, im ungünstigsten Falle fehlen einige vollständig. Aus diesen Vorgängen resultieren zentralnervöse Zellprozessstörungen.
- Zellprozessstörungen in Nerven‑, Glia‑ oder Hirngefäßzellen führen zu den im 3‑Stufen‑Modell beschriebenen ungünstigen funktionalen und strukturellen Hirnveränderungen (→ Abschnitt 1.4), Hirnplastizität und Hirnleistung nehmen kontinuierlich ab.
- Sind von diesen Veränderungen affektrelevante Hirnareale betroffen, können sich Affektstörungen manifestieren oder eine schon bestehende Affekterkrankung weiter verstärken (→ Hirnfunktionsmodell in Abschnitt 1.3.2).
Die Wahrscheinlichkeit zentralnervöser Erkrankungen steigt mit jeder DNA-schädigenden Noxe. Vorschädigungen und DNA-Schädigungen addieren sich zu einem degenerativen Gesamtprozess. Eine Kombination verschiedener Noxen, die auf diese Weise Affektive Störungen begünstigen, ist charakteristisch für die multifaktorielle Ätiopathogenese.
Fehlerhafte DNA-Reparaturen und Zellabbau
Zwar besteht bei somatischen Mutationen die Möglichkeit von DNA-Reparaturen (→ Abschnitt 3.3), fehlerhafte DNA entsteht aber auch gerade aufgrund mangelhafter Reparaturprozessqualität, denn diese nimmt durch Mutationen dafür notwendiger ncRNA-Moleküle und ncRNA-relevanter Gene im Zeitverlauf ebenfalls ab: DNA-Reparaturprozesse unterliegen - wie alle anderen Zellprozesse auch - einem unvermeidlichen Alterungsprozess.
Manchmal sind die nötigen Reparaturpeptide mutationsgeschädigt, beispielsweise das wichtige Reparaturprotein p53, darüber hinaus können kleinere bzw. unauffällige Genschäden von den Mechanismen der Fehlererkennung übersehen werden. In diesen Fällen bleiben der Zelle die DNA‑Mutationen nicht nur dauerhaft erhalten, sie werden auch an Tochterzellen weitergegeben. Letzteres betrifft insbesondere Glia‑ und Hirngefäßzellen, aber auch Nervenzellen, die zur Teilung in der Lage sind, beispielsweise bestimmte Neuronenarten der Hippocampusregion.
Der kontrollierte oder unkontrollierte Zellabbau sind Alternativen zu einer fortbestehenden, aufgrund unzureichender DNA-Reparaturen funktionsgestörten Zelle.
Der programmierte Zelltod (Apoptose) ist ein exakt durchgeführtes Notprogramm nach einem nicht mehr reparablen und gefährlichen DNA‑Schaden, beispielsweise durch Beseitigung maligner (Krebs‑)Zellen nach DNA‑Mutationen.
In vielen Situationen ist die kontrollierte Apotose ein Segen, denn durch sie wird Schlimmeres verhindert. Im Gehirn oder Rückenmark ist die Zellapoptose dennoch ein zweischneidiges Schwert, denn die Neubildung abgebauter Nervenzellen ist in vielen Fällen nicht ohne Weiteres möglich.
Eine andere Form des Zelltods ist die Nekrose, bei der sich Zellen unkontrolliert auflösen und es in der unmitelbaren Umgebung durch entzündliche Prozesse zur Schädigung auch gesunder Zellen kommen kann. Nekrosen im Nervensystem sind besonders fatal, denn dort ist die Regenerationsfähigkeit in verschiedenen Arealen stark eingeschränkt. Nekrotische Prozesse haben daher häufig massiv-dauerhafte Hirngewebeschäden zur Folge.
Exkurs: Somatische Mutationen als Hauptursachen der Zellalterung?
Unter Medizinern und Biologen setzt sich immer stärker die Ansicht durch, dass vor allem akkumulierte somatische DNA-Mutationen hauptverantwortlich für die Zellalterung sind.
Darüber schreibt der Marburger Biochemiker und Alterungsforscher Dietrich O. Schachtschabel, der die Konsequenzen mutierter ncRNA-Gene nicht explizit erwähnte, da der Artikel bereits 2005 erschien und die Wirkungen kleiner ncRNA-Moleküle zu diesem Zeitpunkt immer noch relativ unbekannt waren: „Bereits 1956 hat Harman sog. Radikale als Verursacher des Alterns und auch von degenerativen Krankheiten postuliert («Theorie der freien Radikale»). Aber erst in den letzten Jahren ist diese Theorie stark in den Vordergrund getreten, was mit einer Fülle neuer Forschungsergebnisse zusammenhängt, die diese Theorie stützen. Dabei wird davon ausgegangen, dass vorwiegend im Zellstoffwechsel entstehende freie Radikale als Funktion der Zeit zelluläre Schädigungen insbesondere der mitochondrialen und Zellkern-DNA («Mutationen») verursachen, was zu veränderten Genaktivitäten (Genexpressionen) führt. Dabei können z. B. sog. Signalkaskaden betroffen sein, die die «Botschaft» von Hormonen oder Wachstumsfaktoren in Zellen übertragen. Es können auch Aktivierungen oder Hemmungen von Genen stattfinden, die die Zellproliferation oder das programmierte Absterben (Apoptose) von Zellen steuern.“ (Quelle: Dietrich O. Schachtschabel, Zur Definition des Alterns: Humanbiologische Aspekte, in: Alter als Last und Chance, Konrad-Adenauer-Stiftung, Herder Verlag, Freiburg 2005, http://www.kas.de/..., zur Theorie freier Radikale von Denham Harman → Abschnitt 4.2.3 und zur Wirkung freier Radikale als externe Noxen → Abschnitt 4.13.3 ff. über ionisierende Strahlung bzw. 4.13.6 ff. speziell über reaktive Sauerstoff-Spezies).
Im selben Aufsatz verweist Schachtschabel auch auf Forschungsarbeiten, die sich mit der Proteinbiosynthese im alternden Organismus beschäftigen: „Hinsichtlich einer Zunahme von Mutationen im Alternsgang seien Untersuchungen an isolierten Bindegewebszellen von Menschen unterschiedlichen Alters erwähnt, bei welchen eine Zunahme von «Fehlern» in der DNA mit steigendem Alter festgestellt wurde. Auch bei Untersuchungen an nicht-proliferierenden (...) Zellen (Skelettmuskulatur und Gehirn) der Maus wiesen 1 ‑ 2 Prozent der Gene bei normal gealterten Tieren ‑ im Vergleich mit jungen ‑ eine veränderte Genexpression auf. So wurden im Falle der Skelettmuskulatur 55 Gene (von 6347 untersuchten Genen) mit mehr als 2fach verminderter Genexpression festgestellt, zu denen z. B. Gene für die Synthese von Proteinen des Energiestoffwechsels und des Thyroidhormon-Rezeptors gehörten (Lee et al., 1999, 2000).“ (Quelle wie oben).
Auch hier verweist Schachtschabel ausschließlich auf Gene, denn die Bedeutung verschiedener ncRNA-Moleküle war zum Zeitpunkt der Veröffentlichung des Beitrags noch wenig bekannt. Dass die von ihm beschriebenen Folgen einer verminderten Eiweißsynthese mit hoher Wahrscheinlichkeit vor allem auf mutierte genregulierende ncRNA-Moleküle zurückzuführen sind, ist ein relativ neuer Standpunkt, der aber mit Vermutungen Schachtschabels und der anderer Alterungsforscher im Einklang steht.
4.10.3 Auswirkungen von Keimbahnmutationen auf das Zentralnervensystem
Affektstörungen sind erwiesenermaßen nicht monogenetisch bedingt. Keimbahnmutationen einzelner Gene ‑ oder auch einzelner ncRNA‑Codes ‑ führen daher nicht automatisch zu einer Depression, Manie oder Bipolaren Störung (→ Abschnitt 4.7.1); ein einem solchen Falle wäre nämlich ein eindeutiger Erbgang nachweisbar. Dennoch können Keimbahnmutationen negative Auswirkungen auf die psychiatrische Gesundheit haben. Hier sind zwei Fälle unterscheidbar:
- Patienten mit eindeutig genetisch bedingten (Erb‑)Erkrankungen, beispielsweise dem Klinefelter‑Syndrom oder Chorea Huntington, haben häufig Affektstörungen als sekundäre Begleitsymptome. In den Abschnitten 4.7.2 f. werden dazu verschiedene Szenarien analysiert.
- Affektstörungen können polygenetisch mitverursacht werden, das heißt bestimmte Genveränderungen tragen dazu bei, dass die Wahrscheinlichkeit für eine Affektstörung steigt, was als genetische Prädisposition bezeichnet wird (→ Abschnitt 4.7.5 f.).
Verschiedene Studien deuten darauf hin, dass primäre Affekterkrankungen durch polygenetische Veränderungen mitverursacht werden, was insbesondere für die Bipolare Störung mit Zwillingsstudien nachgewiesen wurde (→ Abschnitte 4.7.6). Hier fand man bei Probanden übereinstimmende Kombinationen auffälliger Genveränderungen, die sogenannten Dispositionsgene. Diese polygenetischen Veränderungen erhöhen das Erkrankungsrisiko, haben also eine Veranlagung bzw. Empfänglichkeit als Konsequenz, die sich erst in Verbindung mit weiteren schädlichen Einflüssen bzw. Noxen entwickeln kann.
Es stellt sich hier ‑ wie auch bei somatischen Mutationen ‑ die Frage, welche Prozesse ncRNA‑Keimbahnmutationen im Detail primär auslösen und wie sich diese dann im weiteren (sekundär) auf das Zentralnervensystem auswirken, um Affekterkrankungen begünstigen zu können.
Keimbahnmutationen nicht-codierender Ribounkleinsäuren und Affektstörungen
Was allgemeine für Gene gilt, nämlich die Existenz Affektstörungen begünstigender Präpositionsgene, muss auch für Codes nicht-codierender Ribonukleinsäuren gelten, denn sie sind als Aktoren und Modulatoren der Proteinbiosynthese zellphysiologisch höchst relevant, ebenfalls für Gene, die im Zusammenhang mit der ncRNA-Synthese wichtig sind. Auf Basis der kausaltheoretischen Modelle (→ Kapitel 1) lässt sich ein Ursache-Wirkungs-Zusammenhang zwischen ncRNA-Keimbahnmutationen und Affektstörungen ableiten:
- Keimbahnmutationen bewirken sowohl ungünstige ncRNA-Codeveränderungen als auch ungünstige Veränderungen ncRNA-relevanter Gene, die später alle Zellen des entstehenden Organismus aufweisen werden.
- In Zellen, in denen mutierte ncRNA-Codes und ncRNA-relevante Gene transkribiert werden, kommt es zu ungünstigen Veränderungen der ncRNA-Versorgung und in der Folge zu Proteinbiosynthesestörungen; derartige Veränderungen können während sämtlicher Lebensphasen auftreten.
- Störungen der Proteinbiosynthese führen zu negativen Peptidprofilveränderungen; entweder ist die Anzahl bestimmter Peptide reduziert oder bestimmte Peptide fehlen vollständig.
- Potentiell kommt es aufgrund einer veränderten Peptidstruktur zu Zellprozessveränderungen. Im Gehirn sind sämtliche Zellarten gefährdet, vor allem trifft das auf Nerven-, Glia- oder Blutgefäßzellen zu.
- Die auf einer durch Keimbahnmutationen gestörten ncRNA‑Synthese beruhenden Prozessveränderungen können zu den im 3‑Stufen‑Modell beschriebenen funktionell‑strukturellen Veränderungen führen, die aber nicht automatisch mit Symptomen affektiver Ekrankungen verbunden sind.
- Zusammen mit weiteren schädigenden externen Einflüssen (Noxen) verschärft sich die Situation jedoch zunehmend, beispielsweise durch weitere somatische DNA-Schäden oder Schädigungen bestimmter Zellbestandteile, wie innerer und/oder äußerer Zellmembranen. Die Wahrscheinlichkeit weiterer Prozessstörungen steigt und damit auch die Wahrscheinlichkeit für weitere Organfehlfunktionen (→ Abschnitt 1.4).
- In affektrelevanten Hirnarealen erhöhen diese degenerative Vorgänge die Wahrscheinlichkeit, bei Überschreiten einer individuellen Schwelle an einer Affektstörung zu erkranken oder eine schon bestehende zu verstärken (→ Hirnfunktionsmodell in Abschnitt 1.3.2).
4.10.4 Bewertung nicht-codierender Ribonukleinsäuren auf Basis neuester Forschungsergebnisse
Eine vergleichende Zellschwachstellenanalyse ergab, dass ncRNA-Versorgungsmängel mit einer hohen Gefahr von Zellprozessproblemen einhergehen (→ Abschnitt 3.4.2). Dabei wurden allerdings (noch) nicht die Ergebnisse aktueller RNA-Forschungen berücksichtigt, und es stellt sich die Frage, ob sie an dieser Einschätzung etwas ändern. Das soll das jetzt anhand folgender Eigenschaften nicht-codierender Ribonukleinsäuren geprüft werden:
- Anzahl von ncRNA-Codes im Verhältnis zu Gencodes,
- Dominanz von ncRNA-Molekülen im Vergleich zu Peptiden bzw. Proteinen,
- ob bestimmte bzw. welche ncRNA-Moleküle ein oder mehrere Gene regulieren und
- ob bestimmte bzw. welche ncRNA-Moleküle zelltypspezifisch agieren.
(1) Anzahl der ncRNA-Codes in Relation zu Peptid-Genen
Ein kurzer Rückblick auf die Ereignisse rund um die „Entschlüsselung der menschlichen DNA“ und die Entdeckung genregulatorischer ncRNA erleichtert das Verständnis und die Problematik der aktuellen wissenschaftlichen Diskussion und verdeutlicht auch den Paradigmenwechsel, in dem sich Biologie, Genetik und Medizin derzeit befinden. Solche Umbrüche sind spannend und eröffnen neue Möglichkeiten, sind häufig aber auch durch Missverständnisse in der wissenschaftlichen Debatte gekennzeichnet.
Die Anzahl menschlicher Gene wird derzeit mit knapp unter 20.000 bis ca. 30.000 Genen angegeben. Das betrifft aber nur Codes von Peptiden, also hauptsächlich Enzyme oder Proteine. Die mindestens ebenso wichtigen ncRNA‑Codes fallen hier komplett unter den Tisch.
Diese Sicht ist spätestens nach der Entdeckung bis dahin unbekannter ncRNA-Moleküle in den 1990er Jahren nicht mehr vertretbar. Jedoch wird erst nach und nach die Bedeutung von ncRNA-Molekülen und deren DNA-Codes erkannt. Wie konnte es zu solchen Fehleinschätzungen überhaupt kommen?
Dazu muss man sich die Entwicklung in der Genetik auf dem Gebiet der Gen‑Sequenzierung etwas genauer ansehen und mit der Entdeckung kurzkettiger, die Genexpression modulierender ncRNA vergleichen, denn beide Ereignisse fanden etwa parallel statt.
Es ergibt sich der Verdacht, dass die schwierige bzw. mangelnde Koordination vieler internationaler Forschungsgruppen, die strikte Ausrichtung der Teilprojekte auf relativ stupide Gen-Sequenzierungsanalysen und die davon scheinbar völlig getrennte und unabhängige RNA-Forschung, die durch die medial gehypte Gen-Sequenzierung deutlich in den Hintergrund geriet, Ursachen sein könnten:
- Das Humangenom-Projekt wurde im Jahre 1990 zunächst mit dem Ziel ins Leben gerufen, die Basenfolgen des menschlichen Genoms zu identifizieren. Forscher aus etwa 40 Ländern unterstützten das Projekt, das weltweit mit großem Medienecho begleitet wurde.
- Im Jahre 2001 gelang die vollständige Sequenzierung eines menschlichen Genoms.
- In den Medien wird dafür gerne der irreführende Begriff „entschlüsselt“ verwendet. Von einer Entschlüsselung des menschlichen Genoms kann aber nicht die Rede sein, denn dazu müsste man auch Bedeutung und Funktionen aller etwa 3,4 Milliarden Basenfolgen kennen, was bisher nicht annähernd der Fall ist, und es ist auch fraglich, ob das in absehbarer Zukunft überhaupt jemals möglich sein wird.
- Die Anzahl der Peptid-Gene wurde auf Grundlage dieser Forschungen 2001 mit ca. 20.000 bis 30.000 beziffert, was weit unter der Schätzung von etwa 100.000 Genen lag, die man vor Beginn des Sequenzierungsprojekts gemacht hatte. Alle 2001 identifzierten Gene nehmen aber nur ca. 2% des Platzes auf dem humanen Gesamtgenom ein.
- Der Nutzen des Restes von etwa 98% des Genoms wurde zunächst als „völlig unklar“ eingestuft und vorschnell als „Gen‑Schrott“, „Gen‑Müll“ oder „Junk DNA“ bezeichnet. Viele Wissenschaftler kritisierten diese Abwertung schon damals, denn es widersprach jeglicher bis dahin gemachten Erfahrung, denn warum sollte die Natur einen derart nutzlosen Aufwand betreiben?
- Die Existenz genregulierender RNA wurde zeitgleich zum Humangenom-Projekt bekannt, spätestens seit den Veröffentlichungen von Andrew Fire und Craig Mello Ende der 1990er Jahre (→ Abschnitt 2.3.3, Quelle: Fire, Mello et al., Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans, Nature Journal no. 391, 2/1998, http://www.ncbi.nlm.nih.gov/...). Für die Entdeckung genregulierender ncRNA erhielten Fire und Mello im Jahre 2006 den Nobelpreis für Medizin, jedoch fand dieses Ereignis in Medien weit weniger Beachtung als die Gensequenzanalysen.
- Fakten wiesen schon seit Ende der 1990er Jahre darauf hin, dass der größte Teil des Genoms RNA codiert und mit der Modulation der Proteinbiosynthese im Zusammenhang stehen muss. Für Entwicklung und Bestand eines Organismus scheint die Genregulation durch ncRNA von entscheidender Bedeutung zu sein, wovon aufgrund des hohen ncRNA-Anteils am gesamten Genom-Code schon ab 2001 sicher ausgegangen werden musste.
- Das Humangenom-Projekt wurde 2004 beendet, seither bemühen sich nationale Nachfolgeprojekte um die weitere Genom-Analyse, beispielweise das Nationale Genomforschungsnetz in der Bundesrepublik oder das National Human Genome Research Institute der Vereinigten Staaten mit dem ENCODE Project. Die national finanzierten Projekte sind weiterhin mit internationalen Forscherguppen besetzt.
- Das ENCODE Project ergab schon 2007, dass ca. 70% der untersuchten DNA-Regionen ncRNA codieren, jedoch wurden die Ergebnisse aufgrund unterstellter methodischer Fehler angezweifelt. Die untersuchten Regionen betrafen zu diesem Zeitpunkt etwa 1% des Humangenoms.
- Die 2012 vorgestellten Ergebnisse des ENCODE Project bestätigten das 2007 publizierte Zwischenergebnis. Es wurden etwa 20.000 RNA-Codes identifziert, insgesamt wird die Anzahl regulatorischer Codes auf 2,9 Millionen geschätzt (Quellen: The ENCODE Project Consortium, Identification and analyses of functional elements in 1% of the human genome by the ENCODE pilot project, Nature 447, S. 799 - 816, 6/2007, http://www.nature.com/nature/journal/...05874 und An integrated encyclopedia of DNA elements in the human genome, Nature 489, S. 57 - 74, 9/2012, http://www.nature.com/...11247, Macmillan Publishers Ltd., London/UK).
- Von geschätzten 2,9 Millionen ncRNA-Codes sind nur ca. 3.700 in allen Zelltypen aktiv, etwa eine Million sind allein nach bisherigem Kenntnisstand zelltypspezifisch relevant.
- Außerdem bestätigte das Projekt Vermutungen über den Umgang einer Zelle mit ihrem Genom. Es stellte sich heraus, dass jeder Zelltyp eine andere Genomregion zur Gensteuerung nutzt, was ebenfalls auf eine zelltypspezifische ncRNA-Steuerung hinweist.
- Setzt man die Anzahl aktiver ncRNA-Codierungen in Relation zu den aktiven Peptid-Codierungen, so betreffen nach den Ergebnissen aus dem Jahre 2012 sogar 95% ncRNA-Codes im Verhältnis zu einem kleinen „Rest“ von 5% für Peptide einschließlich dazugehöriger sonstiger Regulationselemente, beispielsweise Promotor-, Stopp- und Enhancer-Regionen. Die Zahl humaner Peptid-Gene wird vom ENCODE Consortium zu diesem Zeitpunkt mit insgesamt nur 20.687 angegeben.
- Was diese Mengenverhältnisse für Mutationswirkungen im Allgemeinen bedeuten, ist simple Statistik. Wenn 95% des aktiven Genoms ncRNA-Codes enthalten und nur 5% Peptide-Gene einschließlich sonstiger proteinsyntheserelevanter Codes, dann beträgt die Wahrscheinlichkeit, dass eine Mutation jeglicher Art ncRNA-Codes betrifft, ebenfalls 95%, die Wahrscheinlichkeit einer Mutation der restlichen Gene und anderer Codes hingegen nur 5%.
- Viele Wissenschaftler haben die Brisanz dieser Entdeckungen verstanden. So berichtete der Wissenschaftsautor und Biochemiker Volker Henn auf seiner Webseite: „Auch der Medizin können die ENCODE-Daten von Nutzen sein. Mit großen Assoziationsstudien versucht man gerade, die genetischen Ursachen von Krankheiten aufzuklären - doch mit Protein-Genen haben die gefundenen Risikofaktoren meist wenig zu tun. Man steckte in einer Sackgasse, da nicht klar war, wie man diese Befunde deuten sollte. Die ENCODE-Daten zeigen nun, dass diese Risikofaktoren oftmals mit regulatorischen Elementen zusammen fallen - was den Medizinern neue Lösungsansätze aufzeigen könnte.“ (Quelle: Volker Henn, Das ENCODE-Projekt: 80% des Genoms sind aktiv, Zugriff im Mai 2015, http://www.wissensschau.de/...). Und mit den von Volker Henn erwähnten regulatorischen Elementen sind hauptsächlich nicht-codierende RNA gemeint.
Abbildung 35 verdeutlicht den Wissensstand von September 2012 bzw. 2014 über das Verhältnis von ncRNA‑Codes zu Peptide‑Genen auf dem gesamten menschlichen Genom.
ABBILDUNG 35: RELATION ZWISCHEN ncRNA-CODES UND PEPTID-GENEN

Abbildung 35: Das Verhältnis von ncRNA-Codes zu Peptid-Genen ist stark überproportional. Von den aktiven Codes, die etwa 80% des Genoms belegen, entfallen 95% auf ncRNA-Codes, das sind 76% des Gesamtgenoms.
(2) ncRNA-Moleküle modulieren auch die Synthese genregulatorisch relevanter Enzyme und Proteine
Durch Ausführung und Modulation der Proteinbiosynthese stellen ncRNA-Moleküle sicher, dass jeder Zelle die notwendigen Mengen ihrer spezifischen Enzyme und Proteine zur Verfügung stehen. Das betrifft auch Enzyme und Proteine, die selber direkt an der Proteinbiosynthese beteiligt sind, beispielsweise Transkriptionsfaktoren. Aber auch Peptide, die selber wiederum für die ncRNA-Synthese benötigt werden, werden von ncRNA reguliert. Damit dominieren ncRNA auch ihren eigenen Herstellungsprozess.
Die hohe Abhängigkeit der Proteinbiosynthese von ncRNA-Molekülen wird dadurch mit einem weiteren Fakt belegt. Kein anderer Kausalfaktor ist auch nur annähernd so massiv in die Proteinproduktionsmaschinerie involviert wie ncRNA.
(3) Einzelne ncRNA-Moleküle verantworten die Regulation vieler unterschiedlicher Peptide
Ein einziges ncRNA-Molekül kann die Synthese mehrerer hundert Peptide steuern. Schon im Jahre 2008 berichteten die Bioinformatiker Nikolaus Rajewsky und Matthias Selbach vom Berliner Max-Delbrück-Centrum für molekulare Medizin (MDC) von dieser multifunktionalen Fähigkeit einzelner micro-RNA-Moleküle (Quelle: N. Rajewsky, M. Selbach et al., Widespread changes in protein synthesis induced by microRNAs, Nature 455, S. 58 - 63, 9/2008, http://www.nature.com/nature/journal/...07228, Macmillan Publishers Ltd., London/UK).
Auch in den Filmanimationen 9a und 10 wird auf diesen Umstand verwiesen (→ Abschnitt 2.2.4).
(4) Zur Zellspezifität genregulierender ncRNA-Moleküle
Die Ergebnisse des ENCODE-Projekts weisen darauf hin, dass ncRNA vor allem zelltypspezifisch relevant sind. Von den bisher auf 2,9 Millionen geschätzten genregulatorischen ncRNA-Elementen ist nur ein verschwindend kleiner Teil ‑ nämlich ca. 3.700 ‑ in sämtlichen Zellen aktiv. Bisher wurden mindestens 1/3 ‑ also knapp eine Million Elemente ‑ als zelltypspezifisch identifiziert. Es ist daher davon auszugehen, dass hauptsächlich ncRNA-Moleküle Zelldifferenzierung und zellspezifische Prozesse steuern.
Jede Zelle, die sich nur in einem kleinen Detail von einer anderen unterscheidet, verdankt diesen Umstand und damit ihre Existenz vor allem zellspezifisch arbeitenden ncRNA-Molekülen, die in ihrem Stoffwechsel auf eine ganz bestimmte und einmalige Weise aktiv sind und die Genregulation exakt steuern.
Aus dieser Erkenntnis ist zu schlussfolgern, dass zelltypspezifische ncRNA bei der Erkrankung bestimmter Organe mit hoher Wahrscheinlichkeit die Hauptrolle spielen.
Quintessenz: Nicht-codierende Ribonukleinsäuren bedeutender als bisher angenommen
Alle neuen Erkenntnisse über Herkunft und Funktionsweise nicht-codierender Ribonukleinsäuren weisen auf die herausragende Bedeutung dieser Substanzen hin und bestätigen damit auch das schon im Rahmen der kausaltheoretischen Analysen herausgearbeitete Ergebnis aus Kapitel 3, nach dem ncRNA-Moleküle als die mit Abstand bedeutendsten Zellsubstanzen bewertet wurden.
Dabei stützt sich die die Bewertung im dritten Kapitel vor allem auf die Tatsachen, dass ncRNA ihre Aufgaben ausschließlich auf der oberen Zellprozessebene erledigen und als einzige Substanzen aus der Grupppe der Kausalfaktoren sowohl durch Keimbahn- als auch somatische Mutationen gefährdet sind (→ Abschnitt 3.4.2, Tabelle 2).
Die neueren Forschungsergebnisse liefern für diese Einschätzung weitere Argumente, insbesondere die hohe Anzahl der ncRNA-Codes im Vergleich mit der Anzahl von Genen und anderen genetischen Codes, die Multifunktionalität einzelner ncRNA-Molküle und deren Zellspezifität.
4.10.5 Studien über den alters- und krankheitsbedingten Rückgang von RNA- und Proteinbiosynthese
Schon seit Ende der 1960er Jahre, also lange vor der Entzifferung des menschlichen Genoms und der Entdeckung genregulierender Ribonukleinsäuren, zeigen Forschungen, dass Alterung und Erkrankungen mit einem Rückgang von RNA‑ und Proteinbiosynthese assoziiert sind. Das betrifft zum Beispiel folgende Arbeiten:
- F. Orrego (The Rockefeller University, New York City, New York/USA), Synthesis of RNA in normal and electrically stimulated brain cortex slices in vitro, Journal of Neurochemistry, 1967, Vol. 14, S. 851 ‑ 858, Pergamon Press Ltd., http://onlinelibrary.wiley.com/doi/...
Ein Ergebnis der Untersuchung von Orrego war die Reduktion der RNA‑Syntheserate im Hirngewebe zwischen dem 3. Lebenstag und dem Erwachsenenalter im Tierversuch bei Ratten um das Fünffache („The apparent rate of RNA synthesis decreases almost fivefold from 3-day-old to adult rats.“).
- Henry J. Mankin, Patrick G. Laing, Protein and ribonucleic acid synthesis in articular cartilage of osteoarthritic dogs, Arthritis & Rheumatology, Journal of the American College of Rheumatology, Vol. 10 (5), 10/1967, S. 444 ‑ 450, doi 10.1002/art.1780100506, http://onlinelibrary.wiley.com/doi/...
In arthrotischen Gelenken von Hunden findet eine Abnahme der RNA‑ und Proteinbiosynthese statt („From the data obtained, it is apparent that protein and RNA synthesis are markedly decreased in the most severely involved areas and, if not decreased, at least not increased in the less damaged areas.“).
- H. Telhag, C. Gudmundson, Nucleic Acids in Degenerative Joint Disease: An Experimental Study in Rabbits, Clinical Orthopaedics & Related Research, Vol. 88, 10/1972, S. 247 ‑ 251,
https://journals.lww.com/clinorthop/Citation/1972/...
Auch Telhag und Gudmundson fanden heraus, dass von frühen zu fortgeschrittenen Stadien einer Gelenkdegeneration die RNA‑Syntheserate sinkt, in diesem Falle im Gelenkgewebe von Kaninchen.
4.10.6 Empirische Forschungen über micro-RNA-Aktivitäten im Gehirn
Bei Wirbeltieren sind ca. 70% der derzeit bekannten micro-RNA (miRNA) im Gehirn aktiv und beeinflussen sowohl die Struktur und Verknüpfung von Neuronen als auch deren Aktivitäten (Quelle: Alon Chen, MicroRNAs - small but remarkable!, Forschungsbericht 2015 des Max-Planck-Instituts für Psychiatrie, Abteilung für Stress Neurobiologie und Neurogenetik, München 2015, https://www.psych.mpg.de/2060812/...).
Erste Studien und Forschungsprojekte zur Rolle von miRNA bei neurologisch-psychiatrischen Erkrankungen untersuchen Zusammenhänge aus zwei verschiedenen Perspektiven:
- Bei Expression Studies geht es um den Nachweis von Zusammenhängen zwischen Erkrankungen und einem erhöhten oder verminderten Aufkommen bestimmter miRNA-Moleküle in der Hoffnung, auf dieser Basis Therapien zu entwickeln oder die miRNA künftig als Erkrankungsfrüherkennungsmarker zu verwenden.
- Im Rahmen genetischer Studien (Genetic Studies) wird direkt nach miRNA‑Codes bzw. deren Codeveränderungen auf der DNA gesucht, die im Zusammenhang mit Erkrankungen stehen könnten.
Derzeit liegen nur wenige Arbeiten vor. Da nur allgemeine Zusammenhänge zwischen miRNA und Erkrankungen festgestellt werden können, sind die Ergebnisse nicht eindeutig. Auch basieren viele Forschungsergebnisse auf Tierversuchen, was aus wissenschaftlicher Sicht bei der Grundlagenforschung ‑ abgesehen von der ethischen Problematik, Tiere einzusetzen ‑ nicht zu beanstanden ist.
Nicht-codierende Ribonukleinsäuren und die Genese neurologischer Erkrankungen
Im Rahmen ihrer Promotionsarbeit beschäftigte sich Lena Smirnova mit der Regulierung der neuronalen Entwicklung durch miRNA (Quelle: L. Smirnova, Regulation und Funktion der microRNA während der neuronalen Entwicklung und Spezifizierung von Stammzellen, FU Berlin, Berlin 2008, http://www.refubium.fu‑berlin.de/...).
Die Autorin verweist auf die zentrale Rolle der miRNA bei der Differenzierung des Gehirns während der embryonalen Entwicklung und auf die Eigenschaft von miRNA, in allen Spezies hochkonserviert, das heißt in identischer oder fast identischer Form*, vorzukommen: „Viele miRNAs und deren Zielregionen sind hochkonserviert und konnten in einer Vielzahl von Arten nachgewiesen werden. Anhand von entwicklungsbiologischen Studien (...) wurde gezeigt, dass miRNAs an fundamentalen, entwicklungsspezifischen Prozessen wie Proliferation, Apoptose sowie an der zeit- und gewebespezifischen Differenzierung des zentralen Nervensystems (ZNS) beteiligt sind (...). Beim Menschen und der Maus konnten über hundert miRNAs identifiziert werden, von denen eine beträchtliche Anzahl im Nervensystem vorkommt. Obwohl die genaue biologische Funktion der meisten miRNAs noch unbekannt ist, wird angenommen, dass ca. 30% der proteincodierenden Gene von ihnen reguliert werden. Viele klinische Krankheiten wie z. B. Fragiles-X-Syndrom, Spinale Muskelatrophie, DiGeorge Syndrom und neurospezifische Entwicklungsstörungen sind u. a. auf eine defekte miRNABiogenese zurückzuführen.“
* Hinweis: Diese Eigenschaft wird bei der Erarbeitung kausaler Therapiekonzepte mittels ncRNA‑Substitution im Kapitel 7 des Teils II noch eine wesentliche Rolle spielen.
Mittlerweile sind einige Einschätzungen der Autorin veraltet. So werden beispielsweise die durch miRNA regulierten Gene mittlerweile auf über 60% ‑ statt 30% ‑ geschätzt (Quelle: Alon Chen, MicroRNAs ‑ small but remarkable!, Forschungsbericht 2015 des Max‑Planck‑Instituts für Psychiatrie, Abteilung für Stress Neurobiologie und Neurogenetik, München 2015, https://www.psych.mpg.de/2060812/...).
Lena Smirnova untersuchte an Mäusen verschiedene miRNA, die während der Entwicklung des zentralen Nervensystems in hoher Anzahl synthetisiert werden, insbesondere in embryonalen Stammzellen. Danach wird der Code der let‑7‑miRNA im Laufe der neuronalen Differenzierung exprimiert und vor allem immer mehr prozessiert, so dass die Anzahl der reifen miRNA mit der Ausdifferenzierung der Zellen steigt. Ähnliches gilt für die miRNA‑128 und miRNA‑30, was darauf schließen lässt, dass die miRNA‑Prozessierung reguliert wird. Es wurden Translationsinhibierungen und Degradierungen von messenger‑RNA festgestellt. Im ersten Fall wird die Translation unterbrochen (→ Animationen 9a und 10 bzw. Abschnitt 2.2.4), im anderen Fall wird die messenger‑RNA vor einer Translation zerlegt (→ Animationen 9b und 10 bzw. Abschnitte 2.2.3 bis 2.2.5). Bei den Untersuchungen wurden auch miRNA‑Bindungsstellen an der DNA gefunden, was auf eine unmittelbare Beteiligung der miRNA am Transkriptionsgeschehen schließen lässt.
Im EU-finanzierten Forschungsprojekt NEUROmiR (MicroRNA Networks in Neuronal Development and Plasticity) werden seit März 2011 die Beziehungen zwischen miRNA und neurodegenerativen Erkrankungen erforscht. Es werden vor allem Versuche unternommen, einzelne miRNA als neurodegenerativ relevant zu identifizieren.
Im NEUROmiR-Projekt wurde beispielsweise herausgefunden, dass das miRNA‑9‑Molekül für die Ausbildung des Nervensystems bei Zebrafischen mitverantwortlich sein soll (Quellen: http://neuromir.eu/ oder Die heikle Regulierung des Gehirns, CORDIS Forschungs- & Entwicklungsinformationsdienst der Gemeinschaft, 6/2012, http://cordis.europa.eu/...).
Wichtige Fragen im Zusammenhang mit der hohen miRNA‑Konservierung, wie sie schon durch Lena Smirnova nachgewiesen wurde, sind nun, ob miRNA auch bei so unterschiedlichen Spezies wie Säugtieren und Fischen konserviert sind und bei beiden Spezies vergleichbare Funktionen erfüllen, und welche Auswirkungen das auf die Entwicklung künftiger therapeutischer Anwendungen haben könnte. Ob diese Fragen tatsächlich gestellt werden, ist nicht bekannt.
Wim van Oijen forschte von 2011 bis 2015 im Rahmen des NEUROmiR-Projekts u. a. am Molekül miRNA‑137. Dieses soll an Lernvorgängen beteiligt sein und wurde in Hippocampus-Synapsen gefunden. Patienten mit Lernstörungen und geistiger Behinderung weisen verschiedene Mutationen des miRNA‑137‑Codes auf, was eventuell mit deren kognitiven Einschränkungen im Zusammenhang steht. In In-vitro-Experimenten wird nun die Tätigkeit von miRNA‑137 unterdrückt und untersucht, welche Auswirkungen eine geringere Konzentration funktionsfähiger miRNA‑137 in den Neuronen hat.
Einen solchen Zusammenhang wiesen van Oijen und sein Team anhand von Tierexperimenten nach. Die Unterdrückung der miRNA‑137‑Tätigkeit förderte bei Mäusen die Langzeit-Potenzierung (LTP), das heißt eine stabile und langandauernde Verstärkung der Nervenreizübertagung. Parallel konnte die Langzeit-Depression (LTD), also das Gegenteil der LTP, durch eine Senkung der Zahl funktionsfähiger miRNA‑137 blockiert werden. Weitere Erkenntnisse gibt es über die Rolle der miRNA-338 im mitochondrialen Stoffwechsel (Quelle: MicroRNA Networks in Neuronal Development and Plasticity, NEUROmiR‑Networks, CORDIS/EU, http://cordis.europa.eu/...).
Ein anderer Ansatz der miRNA-Forschung ‑ hier im Zusammenhang mit Morbus Alzheimer ‑ betrifft Mikrogliazellen. Harasharan Singh Bhatia beschäftigt sich am Universitätsklinikum Freiburg mit deren Rolle bei der Erkrankungsgenese und mit den dazugehörigen Mechanismen. Mikroglia übernehmen Aufgaben zum Schutz von Nervenzellen und unter bestimmten Umständen können sie auch für deren Untergang verantwortlich sein, beispielsweise durch unkontrollierte Entzündung und/oder Fehlaktivitäten bei der Beseitigung der alzheimertypischen Amyloid-Plaques. Bhatia will nun Mikroglia duch Zugabe von Amyloid-Proteinen künstlich aktivieren, deren miRNA isolieren und anschließend das miRNA-Profil von nicht-aktivierten und aktivierten Mikrogliazellen vergleichen.
In der Dissertation von Katharina Kynast geht es um die Rolle von miRNA bei der neuronalen Schmerzverarbeitung (Quelle: K. Kynast, Die Funktion von microRNAs bei der Entstehung und Verarbeitung von Schmerzen, Fachbereich Biowissenschaften der Goethe-Universität Frankfurt am Main, 2012, Originaldokument → Links & Downloads, Abschnitt G.5). Die Autorin zitiert in ihrer Dissertation zunächst zahlreiche Forschungsarbeiten, in denen die Beteiligung von miRNA bei der Entwicklung des zentralen Nervensystems sowie bei ausgereiften Neuronen nachgewiesen wurde.
Es wurden verschiedene Schmerzversuche unternommen, bei denen die Substanzen Formalin und Zymosan Entzündungen bei Versuchstieren hervorriefen. Unter anderem stellte Kynast einen Anstieg der Katalyse bzw. Regulation verschiedener neuronaler miRNA im Rückenmark und den Spinalganglien fest. Bei einer durch direkte Manipulationen am Rückenmark ausgelösten Neuropathie war eine solcher Effekt nicht erkennbar.
Insbesondere die Rolle der miRNA‑124a konnte mit Hilfe der Entzündungsversuche nachgewiesen werden. Im Rückenmark wurden deren Aktivitäten unterbrochen, was die Synthese entzündungs‑ und schmerzfördernder Proteine ansteigen ließ. Bei den Tieren trat ein vermehrtes Schmerzverhalten auf. Die übermäßige Katalyse von miRNA‑124a führte zu einer Schmerzhemmung.
Zusammenhänge zwischen micro-RNA und affektiven Erkrankungen
Leif G. Hommers, Katharina Domschke und Jürgen Deckert von der Medizinischen Fakultät der Universität Würzburg haben aktuelle miRNA-Studien im Zusammenhang mit psychiatrischen Erkrankungen ausgewertet und den Stand der empirischen Forschung im Jahr 2015 zusammenfassend dargestellt (Quelle: L. G. Hommers, K. Domschke, J. Deckert, Heterogeneity and Individuality: microRNAs in Mental Disorders, Center of Mental Health, Department of Psychiatry, Psychosomatics and Psychotherapy, University Hospital Würzburg, Würzburg, Journal of Neural Transmission 2015, 122: S. 79 - 97, Springer-Verlag Heidelberg, Originaldokument → Links & Downloads, Abschnitt G 5).
Die Autoren stellten fest, dass der überwiegende Teil der Arbeiten sich mit der Rolle von miRNA bei Schizophrenie beschäftigt. Mehrere genetische Studien weisen auf einen Zusammenhang zwischen dem RNA‑Molekül miRNA‑137HG mit dem DNA‑Code rs1625579 und Schizophrenie.
Für Affekterkrankungen und Angststörungen lägen demgegenüber nur wenige belastbare Studienergebnisse vor bzw. viele Ergebnisse seien als vorläufig zu betrachten und müssten in weiteren Arbeiten noch validiert werden. Bisher konnte kein vergleichbares Ergebnis wie bei Schizophrenie erzielt werden.
Es wurden jeweils unterschiedliche miRNA oder am miRNA-Processing beteiligte Gene identifiziert, bei denen ein Zusammenhang bestehen könnte. Die bisherigen ‑ vor allem vorläufigen ‑ Resultate bei der Depression deuten lediglich darauf hin, dass miRNA hier eventuell eine weniger bedeutende Rolle spielen als bei Schizophrenie: „Taken together, present data suggest a smaller contribution of microRNAs towards the risk for MDD [Major depressive disorder, Anm. des Autors] compared to SCZ [Schizophrenia, Anm. des Autors]. Functional studies or data on dimensional phenotype are presently not available.“.
Bei den Expression Studies werden Arbeiten aus Forschungen zitiert, die sich mit der miRNA-Synthese im Zellgewebe unter unterschiedlichen Bedingungen beschäftigten. Bisher wurde weder ein eindeutiger miRNA-Biomarker identifziert noch miRNA, die als Angriffsziele einer Therapie vielversprechend wären.
Eine der von Hommers, Domschke und Deckert kommentierten Expression Studies wurde gemeinsam von Wissenschaftlern der beiden Forschungsinstitute Max-Planck-Institut für Psychiatrie in München und Weizmann Labor für experimentelle Neuropsychiatrie und Verhaltensneurogenetik in Rehovot/Israel unter Führung von Orna Issler durchgeführt. Im Forschungsbericht 2015 des Max-Planck-Instituts für Psychiatrie werden die Ergebnisse dieser Studie jedoch ‑ im Gegensatz zu den Einschätzungen der genannten drei Autoren ‑ sehr vielversprechender gedeutet.
Das Team um Orna Issler hatte im Gehirn und Blut von an depressiv erkrankten Personen geringere Mengen miRNA‑135 gefunden. Diese miRNA steuert zwei Proteine des Serotoninstoffwechsels. Zum einen reduziert sie die Herstellung des Serotoninstransporters SERT, der Serotonin zum Abbau zurück in die Zellen bringt, und zum anderen reduziert sie die Herstellung des Rezeptors HTR1A, der die Serotoninproduktion hemmt. Nach der Vorstellung der Mitarbeiter des Max‑Planck‑Instituts könnte miRNA‑135, wenn sich dieser Funktionsverdacht durch weitere Studien erhärtet, in Zukunft einmal als Antidepressivum zum Einsatz kommen (Quellen: O. Issler, S. Haramati, A. Chen et al., Micro RNA 135 is essential for chronic stress resiliency, antidepressant efficacy, and intact serotonergic activity, 7/2014, MPI für Psychiatrie, Munich/Germany, Weizmann Institute of Science, Rehovot/Israel, http://www.ncbi.nlm.nih.gov/...24952960 und Alon Chen, MicroRNAs - small but remarkable!, Forschungsbericht 2015 des Max-Planck-Instituts für Psychiatrie, Abteilung für Stress Neurobiologie und Neurogenetik, München 2015, https://www.psych.mpg.de...).
Gegen diese Interpretation von Seiten des MPI ist aus kausaltheoretischer Sicht zunächst einzuwenden, dass ein Ursache‑Wirkungs‑Zusammenhang zwischen Serotonin bzw. Serotoninmangel und Affektiven Störungen bisher nicht belegt werden konnte. Viele Forscher und Mediziner gehen von einem korrelativen ‑ und keinesfalls kausalen ‑ Zusammenhang zwischen Serotonin und Affektstörungen aus und lehnen die Monoaminmangelhypothese ab (→ Abschnitte 1.1 f.).
Auf den Seiten 86 bis 89 des Abschlussdokuments von Hommers, Domschke und Deckert (→ Links & Downloads, Abschnitt G.5) können die Zitate und Kommentierungen der jeweiligen Einzelstudien zur Bipolaren Störung, Major Depression und zu Angststörungen im Original gelesen werden.
Erwähnenswert ist noch eine Studie, die ebenfalls am Max-Planck-Institut für Psychiatrie durchgeführt wurde, dort von der Forschungsgruppe Molekulare Psychotraumatologie. Im Tierversuch mit Mäusen und dem Mausmodell zur Posttraumatischen Belastungsstörung wurde nachgewiesen, dass die Menge eines bestimmten miRNA-Moleküls abnahm, wenn das Antidepressivum Fluoxetin erfolgreich einsetzt werden konnte. Diese miRNA könnte daher zukünftig als Marker für die Wirkung von Antidepressiva dienen und die Erarbeitung einer Behandlungsstrategie erleichtern (Quelle: U. Schmidt et al., Therapeutic Action of Fluoxetine is Associated with a Reduction in Prefrontal Cortical miR-1971 Expression Levels in a Mouse Model of Posttraumatic Stress Disorder, RG Molecular Psychotraumatology, 7/2013, Max Planck Institute of Psychiatry, Munich/Germany, http://www.ncbi.nlm...23847554).
Problematiken der miRNA-Forschung und therapeutischer miRNA-Anwendungen
Viele unbeantworteten Fragen über allgemeine und spezielle miRNA-Wirkungen führen auch dazu, dass der therapeutische Nutzen einzelner miRNA-Moleküle noch unklar ist:
- Gehen bestimmte Vorgänge auf ein einziges, wenige oder wesentlich mehr verschiedene miRNA-Moleküle zurück?
- Sind Zusammenhänge zwischen einzelnen miRNA-Molekülen und Erkrankungen kausal oder korrelativ?
- Welche Rolle spielt die potentielle Multifunktionalität von miRNA-Molekülen für die Gefahr potentieller Nebenwirkungen bei der isolierten Gabe eines miRNA-Moleküls?
- Wie ist es zu bewerten, dass ncRNA auf verschiedenen Ebenen genregulieren (→ Abschnitt 2.2.5)?
- Sowohl Expression Studies als auch genetische Studien beziehen sich auf potentielle Keimbahnmutationen. Jedoch treiben vor allem spätere Veränderungen der miRNA-Codes und weiterer ncRNA-Codes aufgrund somatischer DNA-Mutationen und die damit verbundene Fehlerakkumulation Zellalterungsprozesse voran. Damit ist aber eher unwahrscheinlich, dass einzelne ncRNA bzw. miRNA eine Hauptrolle bei degenerativen Erkrankungen spielen, eher ist davon auszugehen, dass Zellen im Laufe der Zeit an völlig unterschedlichen Stellen der DNA immer mehr Mutationsschäden anhäufen und damit immer häufiger ncRNA-Probleme verschiedener Art auftreten und degenerative Krankheitsprozesse vorantreiben.
Katharina Kynast weist in der zitierten Arbeit selber auf zu erwartende Schwierigkeiten hin: „Trotz der genannten Vorteile (...) wird sich die Entwicklung microRNA-modulierender Biologicals vor der Herausforderung sehen, Zell- bzw. Gewebe-spezifische Moleküle zu generieren, um eine systemische Veränderung microRNA-regulierter Mechanismen zu vermeiden. Die Identifizierung Gewebe-spezifischer Target-Erkennungs- und Regulationsmuster für einzelne microRNAs ist bis zum heutigen Zeitpunkt allerdings kaum vorangeschritten. Da microRNAs darüber hinaus auch innerhalb einer Zelle diverse Targets regulieren, könnte die Applikation Gewebe-spezifischer microRNA-Modulatoren zu erheblichen, derzeit nicht abzuschätzenden, Nebenwirkungen führen. Hinsichtlich der biologischen Funktion und Regulation von microRNAs ist in der molekularen Grundlagenforschung immer noch vieles ungeklärt. Vor allem die Identifizierung und Erkennung der koordinierten Regulation gemeinsamer Targets und überschneidender Signalwege sowie die Abgrenzung regulativer Prozesse, die von mehreren microRNAs gleichzeitig kontrolliert werden, gestaltet sich schwierig. Demzufolge ist es bis zu einer möglichen Entwicklung microRNA-basierter Therapeutika vermutlich noch ein langer, jedoch lohnenswerter und vielversprechender Weg.“ (Quelle: K. Kynast, Die Funktion von microRNAs bei der Entstehung und Verarbeitung von Schmerzen, Fachbereich Biowissenschaften der Goethe-Universität Frankfurt am Main, 2012, Originaldokument → Links & Downloads, Abschnitt G 5).
4.10.7 Fazit: Nicht-codierende Ribonukleinsäuren und Affektstörungen
Schon die Bewertung im Abschnitt 3.4 des vorherigen Kapitels ergab, dass nicht-codierende Ribonukleinsäuren von allen Kausalfaktoren über die höchste zellphysiologische Relevanz verfügen. Dabei spielten neueste Erkenntnisse über deren Herkunft und Charakteristika noch gar keine Rolle, die hohe Bewertung erfolgte alleine auf Grundlage eines klassischen Zellprozessmodells, wobei vor allem zwei ncRNA-Eigenschaften entscheidend waren:
- ncRNA‑Moleküle dominieren die Proteinbiosynthese, die sie auf der oberen Zellprozessebene durchführen (hauptsächlich rRNA und tRNA) und modulieren (hauptsächlich miRNA, piRNA oder circRNA).
- ncRNA‑Moleküle werden durch DNA‑Transkription synthetisiert, deren Codes durch Keimbahnmutationen, vor allem aber durch somatische DNA‑Mutationen gefährdet sind.
Die hohe Relevanz nicht-codierender Ribonukleinsäuren wird durch Ergebnisse neuerer und neuester Forschungen, die seit der Entdeckung bis dahin unbekannter ncRNA-Moleküle und des RNA-Interferenzmechanismus durch Andrew Fire und Craig Mello im Jahre 1998 erfolgen, weiter gestützt:
- Derzeit geht man davon aus, dass 76% des gesamten Humangenoms ncRNA codieren. Setzt man diese Zahl in Bezug zu den aktiven Genombereichen, betreffen 95% aller aktiven DNA‑Codes ncRNA, nur ca. 5% codieren Peptide bzw. Enzyme und Proteine. Damit betreffen schon allein aus mathematischen Gründen 95% aller Mutationen ncRNA-Codes.
- Viele miRNA‑Moleküle modulieren wahrscheinlich wesentlich mehr als die Expression jeweils nur eines Gens und steuern die Synthese von bis zu 100 Genen oder mehr (→ Animationen 9a und 10 in Abschnitt 2.2.4). Vor allem solche ncRNA-Moleküle haben für die Zelle eine herausragende Bedeutung.
- Ein Ergebnis des ENCODE‑Projekts betrifft die Zellspezifität der weitaus meisten genregulierenden ncRNA‑Moleküle, insbesondere micro‑RNA, die ausschließlich zellspezifische Aufgaben übernehmen (→ folgender Abschnitt).
Zur Zellspezifität nicht-codierender Ribonukleinsäuren
Es lassen sich zellunspezifische und zellspezifische ncRNA unterscheiden (→ Tabelle 18):
- Ribosomale RNA (rRNA) und Transfer‑RNA (tRNA) bilden zusammen das Rückgrat der Proteinbiosynthese, die sie maßgeblich durchführen. Jedoch sind sie, gemessen an ihrer Differenziertheit, nur durch wenig unterschiedliche Molekülarten charakterisiert und darüber hinaus in sämlichen Zellen nachzuweisen. Sowohl rRNA als auch tRNA gehören daher zu den zellunspezifischen ncRNA.
Menschliche Zellen verfügen nur über vier verschiedene rRNA‑ und nur über etwa 40 verschiedene tRNA‑Typen. Ihre Anzahl ist dagegen in jeder Zelle hoch, denn sie werden aufgrund ihrer Funktionen bei der Durchführung der Proteinbiosynthese in Massen benötigt. Daher sind beispielsweise die besonders häufig benötigten rRNA‑Moleküle durch mehrere redundante DNA‑Codes repräsentiert, so dass die Proteinsynthese nicht sofort zum Erliegen kommt, wenn einer dieser Codes mutiert.
- Die größte strukturelle Vielfalt weisen nach derzeitigem Forschungsstand micro‑RNA (miRNA), circular RNA (circRNA) oder piwi‑interacting RNA (piRNA) auf. Mittlerweile sind ca. eine Million ncRNA‑Moleküle identifiziert, die maßgeblich bestimmen, welche Enzyme, Proteine bzw. Peptide in welchen Mengen hergestellt werden und damit hauptverantwortlich für die Zelldifferenzierung sind. Da also in verschiedenen Zelltypen nur jeweils bestimmte ncRNA‑Moleküle die Proteinbiosynthese individuell modulieren, sind sie als zellspezifisch zu charakterisieren.
Gefahren drohen einer Zelle, wenn zellspezifische ncRNA‑Moleküle die Proteinbiosynthese nicht mehr korrekt modulieren. Das kann an fehlstrukturierten bzw. an einer zu geringen Anzahl bzw. komplett fehlenden ncRNA-Molekülen liegen. Ein solcher Zustand wird als ungünstiger ncRNA‑Status bezeichnet.
Mutationen, Defizite nicht-codierender Ribonukleinsäuren und Affekterkrankungen
Ein ungünstiger ncRNA‑Status mit fehlenden, zu wenig oder fehlstrukturierten ncRNA hat zwei Ursachen, die direkt mit deren DNA‑Codes zusammenhängen:
- Keimbahnmutationen und/oder somatische Mutationen entsprechender ncRNA-Codes auf der DNA und
- Keimbahnmutationen und/oder somatische Mutationen von Enzymen oder Proteinen, die für die ncRNA-Synthese oder das ncRNA-Processing notwendig sind.
Vor allem die Anhäufung somatischer ncRNA-Mutationen im Zeitablauf (Akkumulation) führen zu immer stärkeren Entgleistungen der Proteinbiosynthese. Die Leistungsfähigkeit der Zellen nimmt im Laufe der Zeit stark ab und damit auch die des betroffenen Zellverbunds, Organs bzw. Organsystems. Ein wesentlicher Indikator ist die schon Ende der 1960er Jahre empirisch nachgewiesene Verminderung der Proteinsyntheserate bei Zellalterung.
Diese für einen degenerativen Vorgang typische Entwicklung führt zu komplexen Störungen auf der gesamten unteren Zellprozessebene und betrifft damit potentiell sämliche Zellprozesse. Im Zentralnervensystem kann es nach dem 3-Stufen-Modell zu Funktionsstörungen innerhalb eines Zellverbunds des Nervensystems kommen (→ Abschnitt 1.7); in affektrelevanten Hirnarealen wären dann eine Affektstörung oder die Intensivierung einer schon bestehenden Affektstörung mögliche Folgen.
Vor allem das Zusammenwirken unterschiedlicher Mutationsprozesse ‑ nämlich Keimbahnveränderungen in Verbindung mit der Akkumulation somatischer Mutationen verschiedenen Ursprungs ‑ und weiterer endogener oder exogener Schädigungen ‑ charakterisiert die multifaktorielle Ätiopathogenese.
Empirische Forschungen über Zusammenhänge mit Affekterkrankungen
Durch Studien konnte bisher noch nicht nachgewiesen werden, dass Affektstörungen monogenetisch verursacht und mit einem klar definierten Erbgang auf Nachkommen übertragen werden können, und es ist auch sehr unwahrscheinlich, dass ein monogenetischer Zusammenhang überhaupt existiert.
Es wird jedoch allgemein angenommen, dass polygenetische Keimbahnveränderungen für die Genese affektiver Erkrankungen relevant sind und damit auch die ursprüngliche Erbinformation von Bedeutung ist (→ Abschnitt 4.7). Das heißt: Kombinationen von Keimbahnveränderungen, die ncRNA-Codes betreffen, können die Entstehung einer Affektstörung begünstigen.
Da die DNA zu 95% ncRNA codiert, wirken sich DNA‑Veränderungen mit einer hohen Wahrscheinlichkeit vor allem auf den ncRNA‑Status einer Zelle negativ aus.
In verschiedenen Studien wurde versucht, miRNA‑Moleküle bzw. ‑Codes zu identifizieren, die mit Erkrankungen des Zentralnervensystems bzw. mit Affektstörungen in einem Zusammenhang stehen könnten.
Es gibt viele Anhaltspunkte für die Involvierung diverser miRNA‑Moleküle in die Krankheitsgenese, es konnten aber bisher noch keine Verdachts‑ bzw. Kandidatencodes von miRNA nachgewiesen werden, bei denen verstärkt Affektive Störungen auftreten.
Abschließende Bewertung der Bedeutung nicht-codierender Ribonukleinsäuren für Affektstörungen
Fasst man die wissenschaflichen Erkenntnisse zusammen und bewertet die Bedeutung nicht-codierender Ribonukleinsäuren für die Genese affektiver Erkrankungen, sind bestimmte Schlussfolgerungen zwangsläufig:
- Nicht-codierende Ribonukleinsäuren dominieren die Proteinbiosynthese auf der oberen Zellprozessebene und dominieren damit auch den Zellstoffwechsel auf sämtlichen Ebenen.
- Nicht-codierende Ribonukleinsäuren bzw. deren DNA-Codes sind sowohl durch Keimbahnmutationen als auch durch somatische Mutationen gefährdet.
- 95% der aktiven DNA betreffen nicht-codierende Ribonukleinsäuren, damit betreffen ebenfalls 95% aller Mutationen nicht-codierende Ribonukleinsäuren.
- Ein großer Teil nicht-codierender Ribonukleinsäuren sind zellspezifisch aktiv, indem sie die Proteinbiosynthese zellspezifisch modulieren und damit für die Zelldifferenzierung unerlässlich sind.
- Affektstörungen sind nicht monogenetisch determiniert, jedoch ist ein polygenetischer Zusammenhang wahrscheinlich, ohne dass bisher ncRNA-Zielcodes identifziert werden konnten, die typischerweise bei Affektstörungen auftreten.
- Durch die Akkumulation somatisch bedingter DNA‑Veränderungen ‑ insbesondere von Nerven‑ und Gliazellen ‑ nimmt sowohl die notwendige Anzahl als auch der zellspezifische Mix nicht‑codierender Ribonukleinsäuren im Laufe der Zeit im Zentralnervensystem immer weiter ab und führt zu den im 3‑Stufen‑Modell beschriebenen degenerativen Veränderungen.
- Die wichtigste Schlussfolgerung aus allem lautet: Es sind keine bestimmten ncRNA‑Moleküle für die Krankheitsgenese entscheidend, vielmehr ist die allgemeine Verschlechterung des ncRNA‑Status durch die Akkumulation somatischer Mutationen das Problem, die von Zelle zu Zelle unterschiedlich sein kann und in deren Folge die Leistungsfähigkeit der Zellen immer weiter abnimmt. In affektrelevanten Hirnarealen begünstigen diese Vorgänge die Entstehung Affektiver Störungen.
Zum nächsten Kapitel 4 (Teil B - Sonstige Noxen) bitte hier klicken: ►